来源:中科院之声
2月10日,《美国国家科学院院刊》(PNAS)杂志在线发表了中国科学院生物物理研究所饶子和课题组、胡俊杰课题组和美国科学院院士JodiNunnari课题组合作的研究论文“Structural analysis of a trimeric assembly of the mitochondrial dynamin-like GTPase Mgm1”。该研究解析了线粒体内膜融和蛋白Mgm1在结合GDP状态下的晶体结构,并提出了Mgm1通过多模态聚合和多位点膜结合诱导融合所需的膜弯曲的分子机制模型。
线粒体是由双层膜包被的细胞器,在细胞内持续发生融合和分裂以维持其正常功能。饶子和与胡俊杰团队前期合作阐明了线粒体外膜融合蛋白Mitofusin(MFN)介导膜拴连和融合的机制。然而,线粒体内膜的融合更为复杂,虽然该反应也依赖于发动蛋白超家族的Mgm1或OPA1蛋白,但这些蛋白在发挥功能时又通过蛋白酶水解衍生出含跨膜区的长型和可溶性的短型,两者缺一不可。内膜融合的缺陷导致线粒体DNA的丢失,小鼠的胚胎致死,以及人类视神经萎缩症等遗传疾病。但是其分子机制仍旧不甚明了。
饶子和和闫利明团队解析了酿酒酵母Mgm1蛋白短型全长的结构,发现其单体构象与膜裂解蛋白发动蛋白-1(Dynamin-1)很相似,又形成了首尾相接的三聚体以及反向背靠背的二聚体。胡俊杰课题组通过酶活测定、体外多聚体分析和膜结合等生化实验验证了结构的发现。Nunnari课题组此前独立在酵母细胞中进行了Mgm1的结构功能验证,发现与本文中解析的结构高度吻合,同时也平行验证了Mgm1存在至少两个膜结合位点的重要发现。
该研究投稿的过程中,德国的一个团队报道了嗜热毛壳菌短型Mgm1的晶体和电镜结构,并发现该蛋白可以像膜裂解发动蛋白一样在膜上缠绕成多聚体,以介导线粒体嵴的发生和膜融合可能需要的膜弯曲。本研究发现的“背靠背”结合界面在嗜热毛壳菌Mgm1中保守,但首尾相连的界面和多位点膜结合等发现此前未有报道。因此,本研究提出的全新模型很好地整合了Mgm1膜结合的特点,也部分解释了为何一个形似裂解蛋白的发动蛋白成员能够反过来介导融合。
饶子和、JodiNunnari和胡俊杰是论文的共同通讯作者。饶子和课题组的闫利明、胡俊杰课题组的齐元博及Nunnari课题组的Derek Ricketson为论文的共同第一作者。该研究得到国家重点研发计划、国家自然科学基金和NIH基金等的支持。
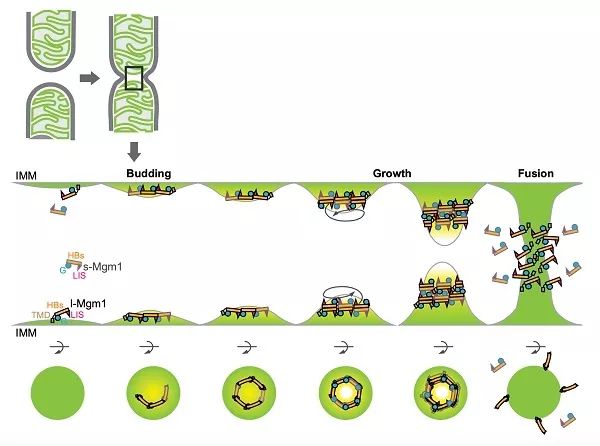
Mgm1介导膜融合的模型图
来源:zkyzswx 中科院之声
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5NzIyNDI1Mw==&mid=2651768338&idx=4&sn=5575e11bc8d9f070cc6d7e4ce7908ba9&chksm=bd272c408a50a5561c92e11c1b5ebfee21a96d0860a9f602ba55c1fa51eb63f7e7df49f7cfe8&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn