撰文 | 酶美
自噬(巨自噬,Macroautophagy)是一种古老而保守的细胞胁迫应答和稳态维持的机制。细胞通过消耗自身胞质组分来协调机体应答外界刺激。选择性自噬能有效清除对细胞有害的受伤细胞器、蛋白聚集体和外源侵入体。机体衰老过程中呈现自噬活性的下降,蛋白降解减慢,并伴随多种有害蛋白聚集和损伤细胞器富集。自噬在多项研究中显示能正向调控生物体寿命。2018年,Ming Chang Hu和 Beth Levine的联合研究成果表明,Beclin1蛋白第121位苯丙氨酸突变成丙氨酸,减少Beclin1蛋白与其负调控蛋白Bcl-2的相互作用。Becn1F121A/F121A 小鼠多器官呈现本底自噬活性的上升,寿命延长(Nature亮点丨首次真正意义上证明自噬可延长小鼠寿命,自噬与衰老领域的扛鼎之作)【1】。然而在有些疾病条件下,自噬活性升高又是有害致命的。如何解释自噬通路截然相反的效果,这需要在不同组织特异和细胞器特异的环境下进行具体分析【2】。

3月28日,Cell在线发表了哈佛大学Alexander Soukas教授实验室的最新研究成果:Mitochondrial permeability uncouples elevated autophagy and lifespan extension。本文发现了一种全新的自噬通路调控线粒体和寿命的机制:TORC2复合物通过SGK1来激活线粒体膜上VDAC1蛋白的降解,从而降低mPTP通道数量,维持线粒体膜的低通透性。mTORC2通路突变体中,线粒体膜通透性升高并引导自噬活性增加,导致寿命缩短(图1)。本文通过模式生物线虫和哺乳动物系统实验均证明了自噬活性的增高在mTORC2突变的背景下是缩短寿命的主要原因。
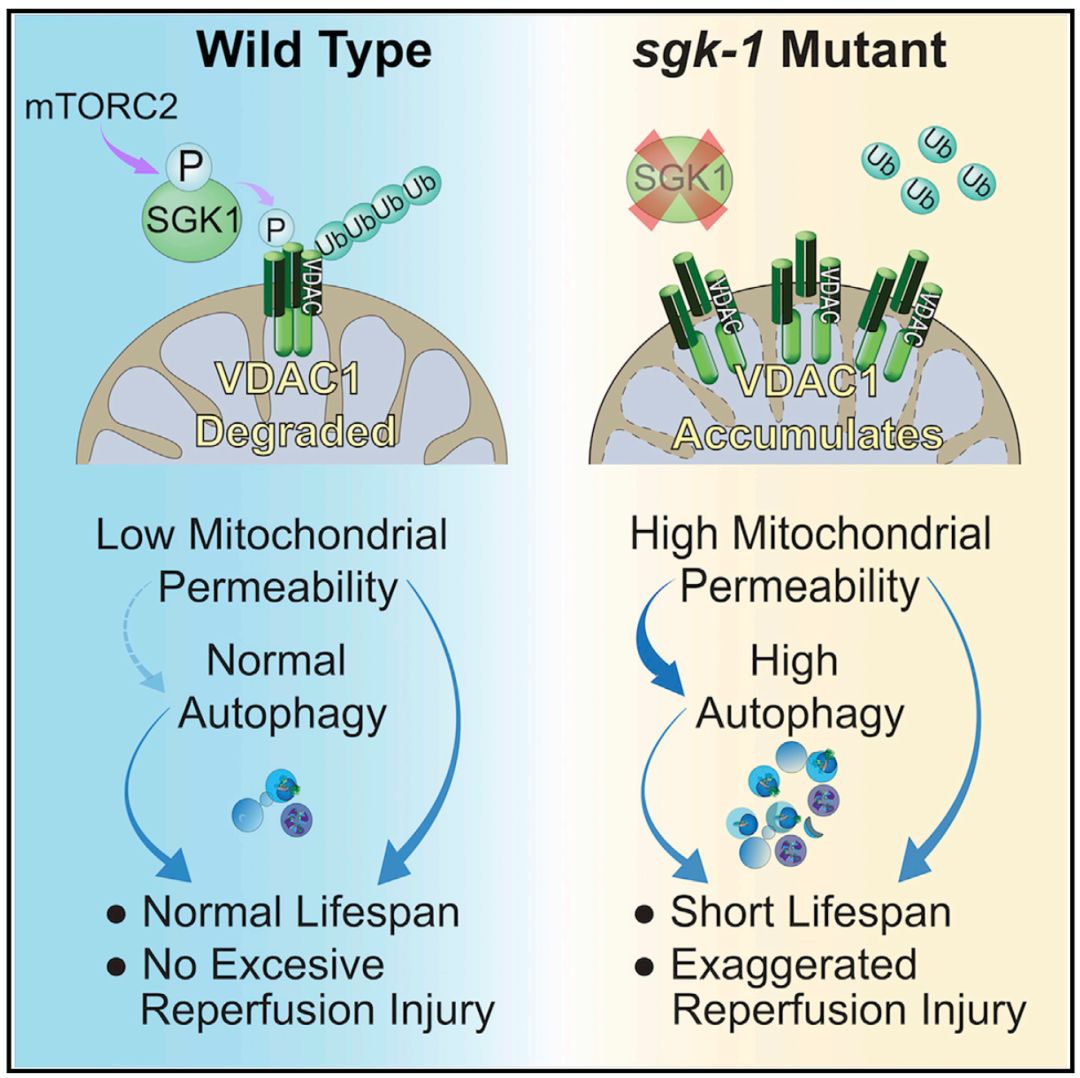
图1 mTORC2调节线粒体膜通透性和下游自噬活性及寿命
TOR复合物有两种:TORC1和TORC2,两种TOR复合物的组成、亚细胞定位和下游激活通路不同(图2)。RICTOR/rict-1是TORC2复合物的特异组分,SGK-1是TORC2复合物激活的下游底物。Soukas教授早期的研究表明,rict-1(-)和sgk-1(-)两种线虫突变体的平均寿命均比野生型线虫短,但是下游分子机制尚不明确【3】。
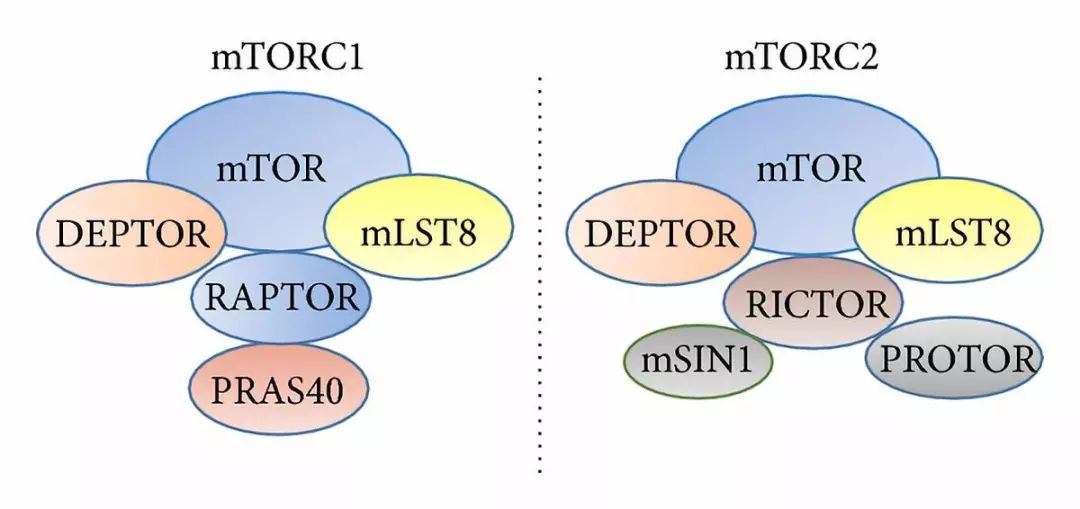
图2 mTORC1和mTORC2蛋白组成不同
rict-1(-)和sgk-1(-)两种线虫突变体中,本文观察到GFP::LGG-1斑点的增多和GFP::LGG-1蛋白切割的增加;同时通过chloroquine抑制溶酶体降解活性并没有阻断其增多。进一步实验表明在突变体中,敲低自噬通路上游激活基因bec-1/Beclin-1和unc-51/ULK1以及lgg-1均能回复寿命缩短的表型。自噬通路下游转录因子HLH-30/TFEB表达增强,显示蛋白水平升高。综合上述实验结果表明,在mTORC2通路突变中,自噬活性增加,自噬通路的流量增大。自噬通路流量增大,反而缩短寿命。
为了找到mTORC2通路下游响应蛋白,本文进行了SGK-1互作蛋白的质谱分析鉴定,结果表明线粒体通透性通道mPTP(mitochondrial permeability transition pore )的相关蛋白高度富集。SGK-1 蛋白和其中VDAC1蛋白有直接相互作用。敲低mPTP相关基因同样能回复mTORC2突变体中寿命缩短的表型。进一步实验分析表明SGK-1激酶能直接对VDAC1蛋白第104位丝氨酸磷酸化,引起了VDAC1泛素化水平升高,蛋白降解增多。sgk-1(-)突变体中,显示VDAC1蛋白水平升高。
VDAC1蛋白水平升高,引起下游一系列的生理反应。mPTP开放随着VDAC1蛋白稳定而增加,线粒体膜通透性增加,可引起自噬流量增加【4】。VDAC1蛋白同时可介导线粒体选择性自噬,VDAC1增加可升高线粒体自噬【5】。这些研究可以解释sgk-1(-)突变体中,自噬活性上升的原因。
本文还同时检测了在其它长寿突变虫株中,线粒体膜的通透性改变是否会改变其长寿表型。结果表明,敲低sdhb-1基因的表达可引起mPTP的开放,可以降低在eat-2和glp-1两种突变体中的寿命延长。过表达VDAC1同样引起mPTP开放增多,同样缩短了在eat-2和glp-1两种突变体中延长的寿命。这些结果揭示了,长寿的突变虫株必需保持线粒体膜的低通透性(图3)。
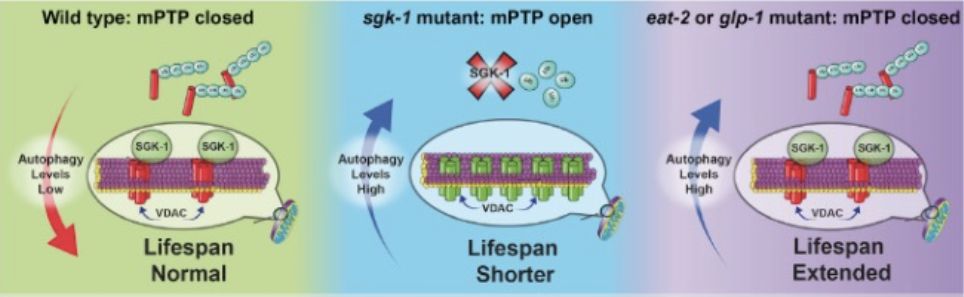
图3 维持线粒体膜的低通透性对寿命延长的作用。
Soukas教授同时也是一名医生,在麻省总医院MGH完成了住院医的培训,本文还进行了小鼠肝脏缺血-再灌注损伤模型的研究。在肝脏移植和肝脏手术中,肝脏缺血-再灌注损伤影响预后。目前已知控制mPTP的开放是降低心肌细胞缺血-再灌注损伤的途径之一【6】。肝脏具有高本底水平的自噬活性,本文研究显示Sgk1敲除的小鼠在肝脏缺血-再灌注后,血清中转氨酶升高,细胞自噬和凋亡增加,提示损伤加剧。本文中通过控制mPTP的开放可有效抑制肝脏缺血-再灌注的损伤,具有重要的临床指导意义!
本文研究揭示了一种全新自噬调控寿命的机制:mTORC2-SGK1通路调控线粒体通透性和自噬活性并影响生物体的稳态维持和寿命。线粒体是储存钙离子的重要细胞器,在线粒体膜通透性增加后,钙离子释放到胞质中,将引起系列下游反应。这也可能是引起自噬活性升高的原因之一。
原文链接:
https://doi.org/10.1016/j.cell.2019.02.013
制版人:珂
参考文献
1. Ferna´ ndez, A.F., et al. (2018). Disruption of the beclin 1-BCL2 autophagy regulatory complex promotes longevity in mice. Nature 558,136–140.
2. Chang, J.T., Kumsta, C., Hellman, A.B., Adams, L.M., and Hansen, M. (2017). Spatiotemporal regulation of autophagy during Caenorhabditis elegans aging. eLife 6, e18459.
3. Soukas, A.A., Kane, E.A., Carr, C.E., Melo, J.A., and Ruvkun, G. (2009). Rictor/TORC2 regulates fat metabolism, feeding, growth, and life span in Caenorhabditis elegans. Genes Dev. 23, 496–511.
4. Elmore, S.P., Qian, T., Grissom, S.F., and Lemasters, J.J. (2001). The mitochondrial permeability transition initiates autophagy in rat hepatocytes. FASEB J. 15, 2286–2287.
5. Geisler, S., Holmstro¨ m, K.M., Skujat, D., Fiesel, F.C., Rothfuss, O.C., Kahle, P.J., and Springer, W. (2010). PINK1/Parkin-mediated mitophagy is dependent on VDAC1 and p62/SQSTM1. Nat. Cell Biol. 12, 119–131.
6. Ong, S.B., Samangouei, P., Kalkhoran, S.B., and Hausenloy, D.J. (2015). The mitochondrial permeability transition pore and its role in myocardial ischemiareperfusion injury. J. Mol. Cell. Cardiol. 78, 23–34.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468166&idx=2&sn=de0bce18850192b2ad7f67814a3d6d3b&chksm=84e2e072b39569649aaa40be032d8f95cc606dca7caeb2acbaeaa25f5a722f4211f6f19cccb6&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn