来源:BioArt
线粒体重塑是维持细胞代谢可塑性的必要条件,能够协助机体适应生长发育中的各种变化,以及应对缺氧或肿瘤发生等环境挑战。线粒体对代谢的调控与其形态变化密切相关,其形态变化主要依赖于融合和分裂这两个相反的动态过程【1】。线粒体内膜重塑对于线粒体融合和分裂至关重要,而动力蛋白样GTPase OPA1(optic atrophy 1)可通过调节该机制来控制融合-分裂的动态平衡。近年来研究发现,定位于线粒体内膜的i-AAA蛋白酶YME1L能通过调节OPA1实现对线粒体融合和分裂的控制,其缺失会导致细胞代谢异常【2】。然而,YME1L在线粒体蛋白稳态调控中的作用仍不甚清楚。
2019年11月7日,来自德国马克思-普朗克生物衰老研究所的Thomas Langer教授(德国科学院院士)带领的团队在Nature杂志发表了题为Lipid signalling drives proteolytic rewiring of mitochondria by YME1L的文章,揭示了mTORC1-LIPIN1-YME1L轴是代谢-线粒体动态平衡这一互作过程中线粒体蛋白稳定的翻译后调节因素。

谷氨酰胺可以作为TCA循环的另一种碳源来维持柠檬酸水平,这对在无锚定条件下生长的细胞尤为重要【3】。通过构建三维细胞球体模型,作者发现YME1L对于细胞谷氨酰胺利用以及细胞球(spheroids)形成作用关键。相比于单层细胞,细胞球中YME1L底物水平显著下降,而在YME1L突变或敲除细胞中这些底物的表达水平会发生上调。由于细胞球中氧气含量较低,作者推测缺氧诱导因子HIF1α可能影响了YME1L的表达水平,实验证明HIF1α的确能促进YME1L底物水平的下降。此外,YME1L蛋白水平在细胞球或低氧培养的细胞中降低,而由于YME1L在表达YME1L突变体的细胞中水平稳定,这种下降趋势可能反映了YME1L的自催化降解。
为探明YME1L自催化降解的原因,作者进行了定量蛋白质组分析,发现当野生型MEF细胞转移至缺氧状态时,其线粒体总蛋白含量显著降低,而YME1L敲除细胞无明显变化。在缺氧状态下,包括蛋白质转位酶亚基、线粒体脂质转移蛋白、OPA1等与线粒体代谢有关的29种YME1L底物水平会发生YME1L依赖性下降。因此,YME1L介导的蛋白水解能维持常氧条件下的线粒体蛋白稳定,并能在缺氧条件下重塑线粒体蛋白组。此外,作者发现YME1L缺失细胞的细胞球生长障碍并不是这些细胞固有的线粒体破碎所导致的。
之前研究发现缺氧和谷氨酰胺缺乏会抑制mTORC1信号【4】,作者在此发现YME1L介导的蛋白水解会导致mTORC1下游靶点核糖体蛋白S6的去磷酸化,正常细胞mTORC1抑制剂处理后YME1L底物水平下调,而YME1L敲除细胞则不会出现该变化。线粒体蛋白水解受mTORC1的显著调控,即mTORC1的激活能抑制YME1L对蛋白的降解,而mTORC1的抑制则促进YME1L介导的蛋白水解。作者进一步研究发现,mTORC1抑制状态下YME1L介导的蛋白水解通过降解蛋白转位酶和脂质转移蛋白,能在很大程度上限制线粒体的生物合成,并在代谢上重新连接原有的线粒体,以便为回补反应维持TCA循环的水平。
接下来,作者研究了mTORC1是如何影响YME1L介导的蛋白水解的。mTORC1能通过促进脂类产生来维持生物膜的生物合成,而mTORC1抑制会导致正常细胞和YME1L敲除细胞线粒体膜上磷脂酰乙醇胺(PE)特异性减少。同样,缺氧状态或谷氨酰胺缺乏同样会引起PE减少。因此,线粒体PE水平的降低可能激活了YME1L介导的蛋白水解。为了直接监测PE水平是如何影响YME1L介导的蛋白水解的,作者在脂质体中对这一过程进行了重构,发现mTORC1信号能在线粒体中调控PE水平,并决定了YME1L介导的蛋白降解。通过esiRNA抑制5种能调控脂类代谢的mTORC1靶蛋白并检测YME1L底物的积累,作者发现只有敲低磷脂酸(PA)磷酸酶LIPIN1才能在mTORC1抑制后的细胞中破坏YME1L依赖性的蛋白降解,证明mTORC1影响下的LIPIN1能调控线粒体中PE的积累。而磷脂酰胆碱(PC)合成的限速酶CCTα位于LIPIN1下游通过YME1L调节蛋白水解。因此,mTORC1能通过磷脂信号级联调节线粒体PE,即mTORC1水平降低会抑制LIPIN1,下调PA和CCTα-依赖性PC的形成,最终限制PS运输到线粒体并阻碍PISD介导的PE合成。最后,作者研究了YME1L依赖性蛋白水解在肿瘤发生中的作用,发现YME1L介导的线粒体蛋白稳态重塑会促进胰腺导管腺癌(PDAC)细胞的生长,也证明了YME1L与肿瘤发生中的病理学变化密切相关。
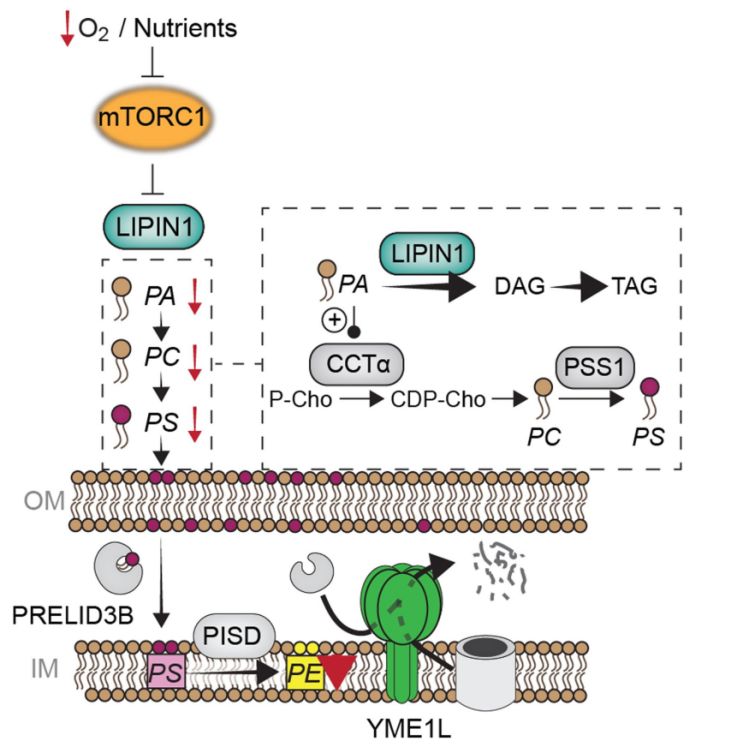
图1 mTORC1–LIPIN1–YME1L轴对线粒体蛋白质组重塑的调控
简而言之,本文发现缺氧或营养缺乏引发的mTORC1抑制会使LIPIN1去磷酸化并导致PA、PC和PS水平的级联下降,限制了PS向线粒体内膜的转移及PE的积累,最终激活了YME1L介导的蛋白水解,重塑了原有的线粒体蛋白质组。此外,YME1L介导的线粒体蛋白组重塑会促进PDAC等肿瘤的发生,这也使YME1L有望成为肿瘤治疗的新靶点。
原文链接:
https://doi.org/10.1038/s41586-019-1738-6
制版人:珂
参考文献
1. Mishra, P. & Chan, D. C. Metabolic regulation of mitochondrial dynamics. J. Cell Biol. 212,379–387 (2016).
2. Mishra, P., Carelli, V., Manfredi, G. & Chan, D. C. Proteolytic cleavage of Opa1 stimulates mitochondrial inner membrane fusion and couples fusion to oxidative phosphorylation. Cell Metab. 19, 630–641 (2014).
3. Jiang, L. et al. Reductive carboxylation supports redox homeostasis during anchorage-independent growth. Nature 532, 255–258 (2016).
4. González, A. & Hall, M. N. Nutrient sensing and TOR signaling in yeast and mammals. EMBO J. 36, 397–408 (2017).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652477483&idx=4&sn=c97b71455a411a56b30afe28fa6292cb&chksm=84e20b9fb3958289d95ac88e72d640838b18f26d9a59e4b30ec644db70ce64d10f348fbb53b0&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn