责编 | 兮
来源:BioArt
在世界范围内,食管鳞癌大约占所有食管癌的90%,它仍然是一个高侵袭性和高致死性肿瘤,尤其是对有局部浸润和淋巴节转移的晚期食管鳞癌尚无有效治疗方法;因此,亟需开发有效的二线治疗方案【1】。在基因组水平上,芯片筛查提示食管鳞癌存在多种基因突变,如p53、Rb和CDKN2A失活突变,NFE2L2、NOTCH1/2、MLL2和EP300激活突变或cyclin D1基因扩增等【2】。
Cyclin D1是促进细胞周期从G1到S期的重要调控因子。Cyclin D1-CDK4/6可以磷酸化并抑制Rb蛋白,激活E2F转录因子,从而促进目标基因转录和细胞周期进展。除调节细胞周期外,cyclin D1-CDK4/6仍可调节细胞迁移、应激反应和细胞代谢。由于基因扩增或降解失调节(如Fbxo4失活突变),cyclin D1在多种人类肿瘤中表达升高,如胰腺癌、非小细胞肺癌、乳腺癌、头颈部鳞癌、黑色素瘤、子宫内膜癌、结直肠癌及套細胞淋巴瘤等【3】;研究发现Fbxo4突变可致cyclin D1表达升高,从而促进食管鳞癌发生、发展【3,4】,这些结果提示靶向Fbxo4-cyclin D1调节失常可用于治疗食管鳞癌。
在多种人类肿瘤中cyclin D1表达增高,因此靶向cyclin D1相应CDK激酶理论上可用于肿瘤治疗。基于上述事实,目前已有多种CDK4/6抑制剂被研发出来,其中包括3种被美国食品药品监督管理局(FDA)通过的用于治疗乳腺癌的药物,包括帕博西尼(Palbociclib)、玻玛西尼(Abemaciclib)和莱博西林(Ribociclib)。上述药物正在被进行广泛的基础研究和临床试验,除乳腺癌外,还被研究用于治疗胰腺癌、非小细胞肺癌、头颈部鳞癌、黑色素瘤、肝细胞肝癌、前列腺癌、食管癌、中枢神经系统肿瘤、肉瘤和淋巴瘤等。虽然肿瘤细胞开始对CDK4/6抑制剂敏感,但最终会产生耐受,所以开发一种新方案以克服CDK4/6抑制剂耐受便显得尤为重要【5】。
细胞代谢重编程被认为是肿瘤发生的一个重要标志。肿瘤中存在的代谢失调节主要包括:Warburg效应和谷氨酰胺降解活化。研究发现谷氨酰胺降解或谷氨酰胺依赖主要调控机制包括:癌基因表达升高或过度活化,如c-Myc、N-Myc或ErbB2等,或抑癌基因失活,如p53和Rb等【6】。谷氨酰胺生物学功能主要包括:
1) 通过α-酮戊二酸在三羧酸循环(TCA cycle)中代谢而提供能量;
2) 提供生物合成所需底物,如为嘌呤和嘧啶从头合成、非必须氨基酸合成、葡萄糖胺合成等提供氮源;
3) 合成还原型谷胱甘肽用以抵抗活性氧所致损伤。
由于谷氨酰胺具有上述重要生物学功能,所以它的代谢可有效促进肿瘤发生、发展。目前,尚不清楚是否存在其它可促进谷氨酰胺依赖的信号通路,进一步了解谷氨酰胺代谢分子机制利于为肿瘤治疗提供新靶点。
2019年3月21日,美国南卡罗来纳医科大学生物化学和分子生物学系研究人员在Nature Communications上发表了题为Targeting Glutamine-addiction and Overcoming CDK4/6 Inhibitor Resistance in Human Esophageal Squamous Cell Carcinoma的论文【7】,首次揭示了Fbxo4-cyclin D1调节失常可促进食管鳞癌细胞产生谷氨酰胺依赖,此特性可被靶向治疗食管鳞癌并能有效克服CDK4/6抑制剂耐受。

在最新的这项研究中,研究发现Fbxo4失活突变及cyclin D1-CDK4/6活性升高可促进食管鳞癌细胞产生谷氨酰胺依赖。在正常细胞中,Fbxo4-cyclin D1平衡调节可保持下游通路及能量代谢稳定;在肿瘤细胞中,Fbxo4-cyclin D1调节失常通过抑制Rb及激活mTORC1引起能量产生和消耗之间的不平衡,最终导致肿瘤细胞谷氨酰胺摄取增加及依赖其提供能量。利用这一特性,谷氨酰胺酶抑制剂CB-839和二甲双胍/苯乙双胍联合用药可促使能量代谢失衡,进而诱导肿瘤细胞凋亡并抑制其增殖。此外,本研究亦发现耐受CDK4/6抑制剂Palbociclib的肿瘤细胞存在代谢重调,主要表现为谷氨酰胺摄取增加,谷氨酰胺酶1 (GLS1) 表达升高,最终引起谷氨酰胺依赖;据此,耐受CDK4/6抑制剂的细胞对CB-839和二甲双胍联合用药敏感。以上研究结果分别在细胞水平及裸鼠移植瘤模型中得到实验证实。
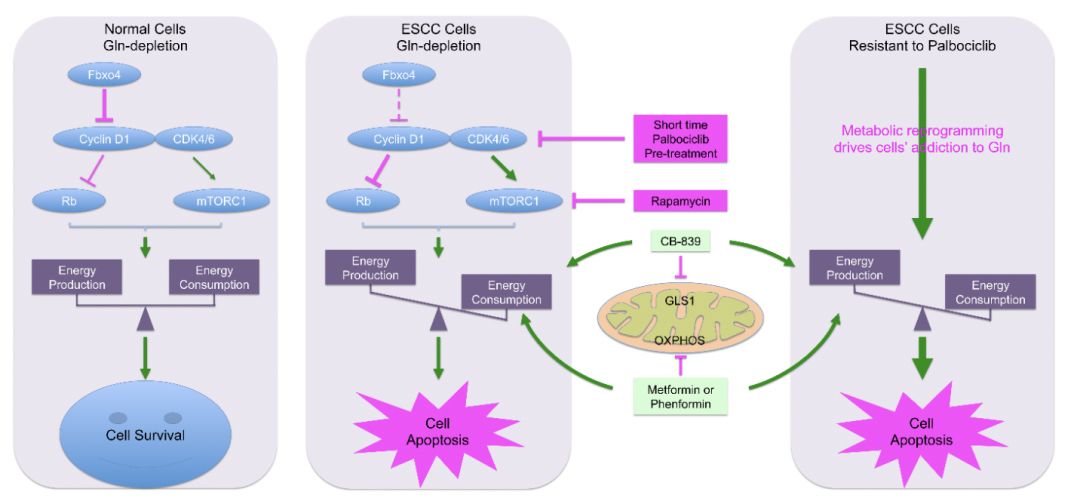
总体来说,该项研究阐明了Fbxo4-cyclin D1调节失常促进谷氨酰胺依赖的分子机制,为治疗食管鳞癌及克服CDK4/6抑制剂耐受提供了有力的生物化学和分子生物学依据。
据悉,美国 Hollings Cancer Center郄硕博士为论文第一作者,通讯作者为其博士后导师J. Alan Diehl教授。
原文链接:
https://www.nature.com/articles/s41467-019-09179-w
制版人:子阳
参考文献
1. Rustgi AK, El-Serag HB. Esophageal carcinoma. N Engl J Med 371, 2499-2509 (2014).
2. Chen XX, et al. Genomic comparison of esophageal squamous cell carcinoma and its precursor lesions by multi-region whole-exome sequencing. Nat Commun 8, 524 (2017).
3. Qie S, Diehl JA. Cyclin D1, cancer progression, and opportunities in cancer treatment. J Mol Med (Berl) 94, 1313-1326 (2016).
4. Qie S, et al. Fbxo4-mediated degradation of Fxr1 suppresses tumorigenesis in head and neck squamous cell carcinoma. Nat Commun 8, 1534 (2017).
5. Klein ME, et al. CDK4/6 Inhibitors: The Mechanism of Action May Not Be as Simple as Once Thought. Cancer Cell 34, 9-20 (2018).
6. Altman BJ, et al. From Krebs to clinic: glutamine metabolism to cancer therapy. Nat Rev Cancer 16: 619-634 (2016).
7. Qie S, et al. Targeting Glutamine-addiction and Overcoming CDK4/6 Inhibitor Resistance in Human Esophageal Squamous Cell Carcinoma. Nat Commun 10, 9179 (2019).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652467917&idx=3&sn=8c18ce23193e144088bf648745b50f00&chksm=84e2e179b395686ff8bf3d9c2f8a9529b3e59b2203f69dfa393a026b4d499fd86d6f4a7b7195&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


