来源:中科院之声
碱基编辑技术是基于CRISPR系统开发的基因组定向修饰技术。该技术由于不需要DNA双链断裂和外源供体DNA可以实现对目的碱基的精准替换,在疾病治疗、植物性状改良等方面具有很大应用潜力。中国科学院遗传与发育生物学研究所高彩霞研究组长期致力于植物基因组编辑技术的创新及应用研究,前期已经在植物中建立了完善的胞嘧啶碱基编辑器(CBE)和腺嘌呤碱基编辑器(ABE)技术体系,但是发现胞嘧啶碱基编辑器在基因组水平存在脱靶效应。为解决这一问题,高彩霞研究组通过对人类胞嘧啶脱氨酶(APOBEC3B)蛋白的理性设计,并结合新型的胞嘧啶碱基编辑筛选方法,开发出了新型高精度、高编辑活性的胞嘧啶碱基编辑工具。
研究人员首先在水稻原生质体中建立并优化了基于R-loop的高通量碱基编辑器特异性评估方法。该方法利用CBE作用于单链DNA的特性,通过SpCas9的正交蛋白nSaCas9在编辑靶点外的基因组区段诱导R-loop,从而人为制造单链DNA(ssDNA)区域。如果CBE的脱氨活性在这些区域产生脱靶编辑,可以通过高通量测序进行富集检测。该工作首先对已报道的5个胞嘧啶碱基编辑器分别通过R-loop方法和全基因组测序(WGS)进行特异性检测,发现R-loop方法与WGS的结果一致,证明了R-loop方法的可靠性。且该方法与WGS相比,更加快速、便捷和经济。
在此基础上,研究人员对一系列理性设计的基于人源APOBEC脱氨酶的CBE的特异性进行筛选。他们以编辑效率高且编辑窗口小的A3Bctd作为蛋白进化的原始底盘,根据蛋白结构信息预测与其脱氨的催化活性和ssDNA结合能力相关的结构域以及这些结构域中的重要氨基酸残基,通过理性设计获得16个单氨基酸替换的CBE变体。通过筛选获得了靶向效率维持较高且能较显著降低脱靶效应的7种单个氨基酸突变(R211K, T214V, R311K, Y313F, D314R, D314H 和 Y315M)。为了进一步降低CBE的脱靶效应,研究人员将这些单氨基酸突变进行组合创制了9个多氨基酸替换变体,最终筛选得到了两种靶向编辑效率较高且特异性显著增加的CBE变体:A3Bctd-VHM-BE3和A3Bctd-KKR-BE3。对编辑产物的分析显示,这两种变体在编辑窗口内主要产生单个C或者两个C的替换,显著提升了编辑精确性。最后,通过对150个水稻编辑植株的全基因组测序数据进一步证明了A3Bctd-VHM-BE3和A3Bctd-KKR-BE3的高特异性。
该工作结合基于结构信息的蛋白理性设计、植物个体全基因组脱靶检测技术和高通量R-loop脱靶检测技术,进一步提高了单碱基编辑的精确性,开发出的两种能保持高编辑效率且无随机脱靶效应的CBE变体,为基因治疗和植物分子设计育种提供了有力工具支撑。
相关研究成果结果于7月27日在线发表在《分子细胞》(Molecular Cell)杂志(DOI:10.1016/j.molcel.2020.07.005)。遗传发育所高彩霞研究组博士生靳帅、费宏源、朱子旭以及微生物所副研究员骆迎峰为本文共同第一作者;高彩霞与青年研究员王延鹏为本文共同通讯作者;明尼苏达大学博士张峰,遗传发育所研究员陈宇航也参与了这项研究。该研究得到国家转基因重大科技专项、中科院战略性先导科技专项(A类)、国家自然科学基金委和中科院青促会项目的资助。
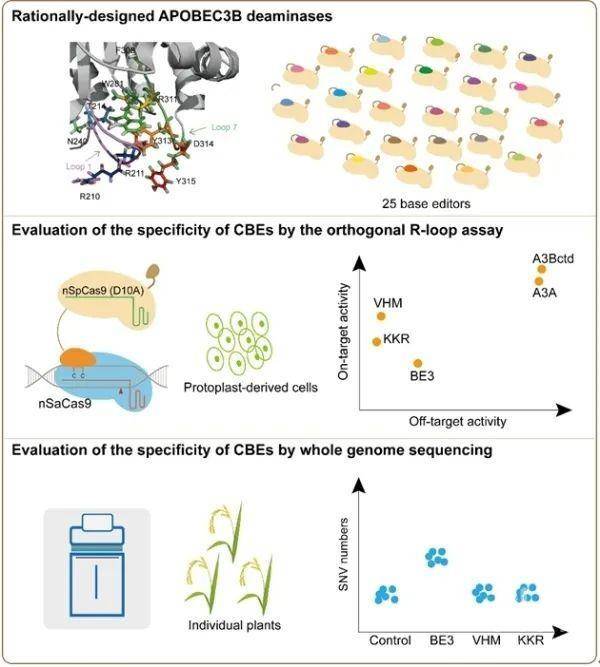
理性设计改造胞嘧啶脱氨酶APOBEC3B,筛选精准碱基编辑器。上:根据APOBEC3B结构信息理性设计并创制突变体。中:水稻原生质体中建立R-loop方法,高通量检测胞嘧啶碱基编辑器(CBE)变体特异性。下:利用全基因组测序,检验CBE变体特异性。
来源:zkyzswx 中科院之声
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5NzIyNDI1Mw==&mid=2651777362&idx=3&sn=e75edc09685a8147db13beb1a26eb4ac&chksm=bd2703008a508a169aefb7769eb335145bc0812fe9b9de0127a2d6fd1f26150e40c5be181910&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



