来源:CBG资讯
原标题:Tereda课题组JACS:手性脲酸盐作为强碱性催化剂催化的不对称Michael加成反应
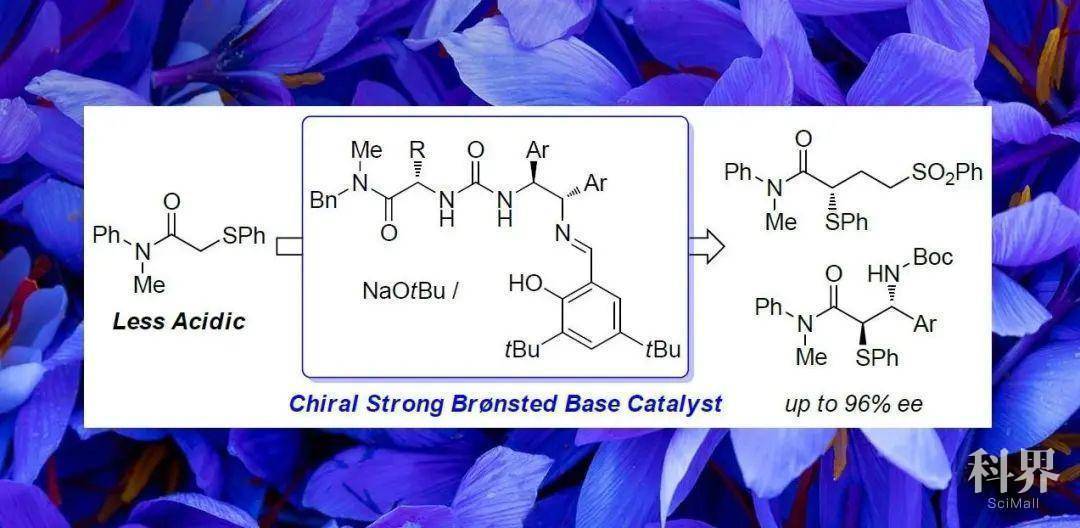 近年来,手性质子碱催化的不对称加成反应能够将多种潜手性亲核试剂转化为具有高化学附加值的手性产物。然而,该类催化剂的应用范围受限于其分子本身的碱性,传统的手性质子碱催化剂(如手性三级胺、手性胍),仅适用于含有酸性质子的底物。
近年来,手性质子碱催化的不对称加成反应能够将多种潜手性亲核试剂转化为具有高化学附加值的手性产物。然而,该类催化剂的应用范围受限于其分子本身的碱性,传统的手性质子碱催化剂(如手性三级胺、手性胍),仅适用于含有酸性质子的底物。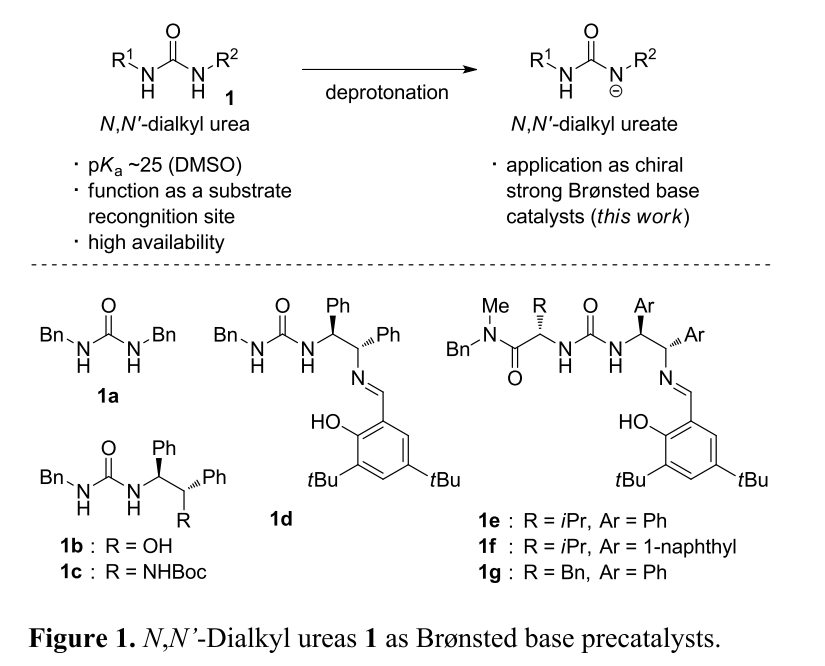
(图片来源:J. Am. Chem. Soc.)
作者首先对该反应的可行性进行了研究(Table 1)。作者选取了2-苯硫基乙酰胺(pKa = 25 in DMSO)与α,β-不饱和砜的Michael加成反应为模型反应进行了探索。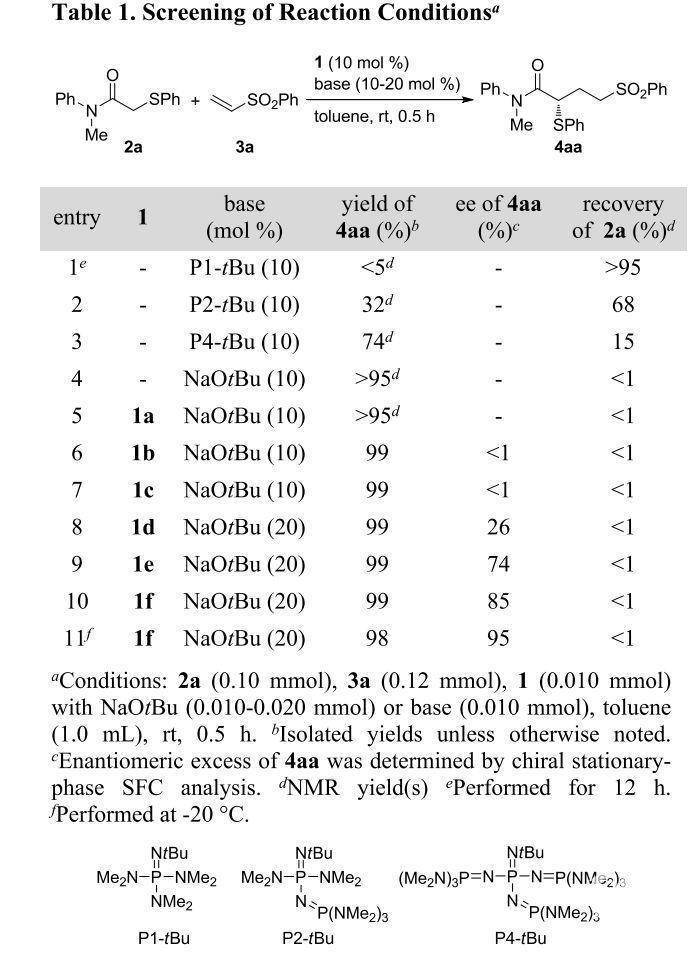
(图片来源:J. Am. Chem. Soc.)
作者随后进行了一系列控制实验(Scheme 1)。当以KOtBu或LiOtBu为无机碱时,反应无立体选择性或无反应发生,说明脲酸盐的抗衡阳离子对反应至关重要;而以NaHMDS为碱时得到与NaOtBu类似的结果,这也证明了作者的上述结论。催化剂的光学活性对反应十分重要,作者以不同光学纯度的催化剂催化反应,发现催化剂的ee值与产物的ee值呈正相关。作者同时设计了催化剂1h-j,并将其用于催化不对称Michael加成反应。脲其中一个氮原子被烷基化后对反应的立体选择性影响不大,因此对氮原子进行烷基化可能是另一种对催化剂结构改造的方法。而将酚羟基烷基化后会生成消旋产物,证明酚羟基在生成新碳碳键的立体控制过程中起决定性作用。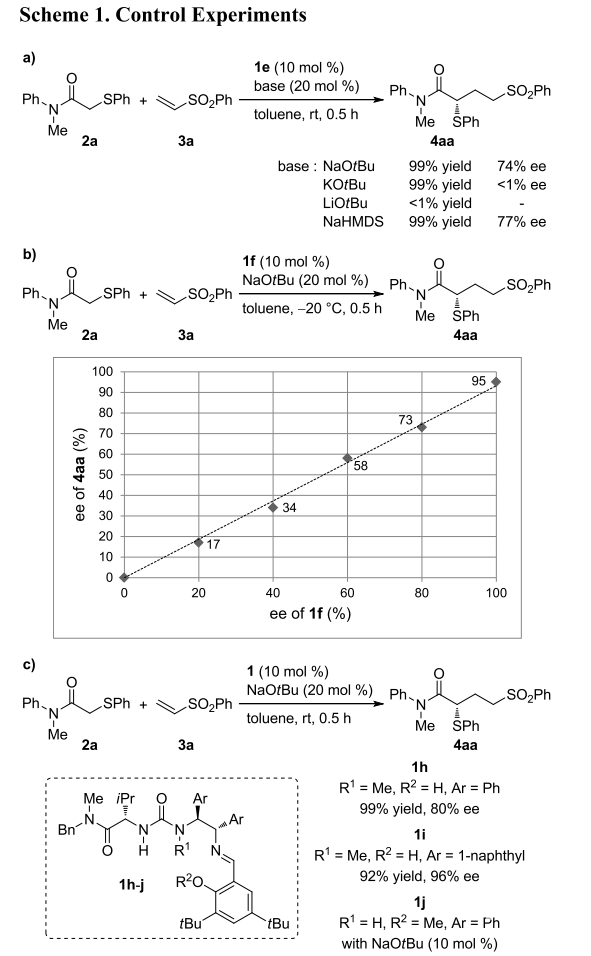
(图片来源:J. Am. Chem. Soc.)
作者随后在最优条件下对该反应进行了底物扩展(Scheme 2)。首先,作者对亲核试剂的N,N-二烷基酰胺进行了扩展,发现酰胺氮原子的取代基以及硫原子的取代基对反应影响不大,底物均以高收率、高立体选择性得到加成产物;而α-甲基酰胺未发生反应。作者进一步对亲电试剂进行了扩展,发现不同的亲电试剂,如不饱和砜、不饱和酯以及亚胺等均可发生反应,以优异的对映选择性和非对映选择性得到加成产物,这证明手性脲酸盐是催化酰胺对Michael受体不对称加成的优良催化剂。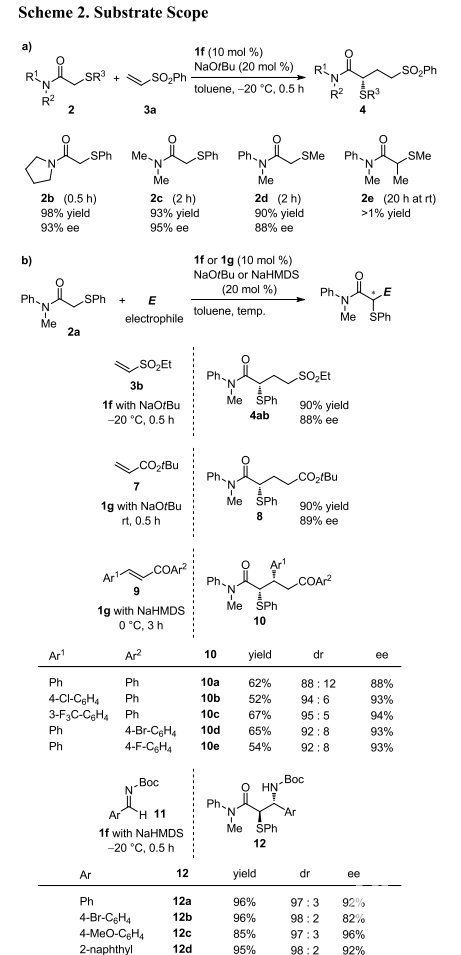
(图片来源:J. Am. Chem. Soc.)
总结:
日本东北大学的Tereda教授设计发展了一种新型的手性脲酸盐作为不对称质子碱催化剂催化的α-硫醚酰胺对Michael受体的不对称Michael加成反应。该底物的弱酸性使得其转化在传统的手性质子碱催化剂作用下难以实现。相信该理念将进一步拓宽手性质子碱催化的应用范围,为开发新型的手性质子碱催化的不对称反应奠定坚实基础。
来源:BeanGoNews CBG资讯
原文链接:https://mp.weixin.qq.com/s?__biz=MzI4ODQ0NjUwMg==&mid=2247499571&idx=2&sn=9f680293511dc4825c9ca6b373b479a1&chksm=ec3cfe7adb4b776c2db4c618fd4b5674d122cc6832e88be3c814acfdd82995b83e657e995ec6#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


