对认知和行为障碍背后的机制的已有研究一直集中在神经元的结构和功能异常方面。

新兴证据表明,包括小胶质细胞在内的非神经元细胞在提供代谢支持、调节神经递质的释放和摄取以及调节突触可塑性方面必不可少,已有研究揭示出其参与这些疾病的病因,并提出了新的治疗目标,但其调控机制尚不明确。
小胶质细胞吞噬作用后,活性氧(reactive oxygen species, ROS)的含量迅速增加,此过程有助于吞噬细胞内容物的降解,也需要大量的三磷酸腺苷(ATP)供应,同时可能对周围神经元产生有害影响。
线粒体通过分子结构和信号传导的调节来密切地控制ROS和ATP的生成,与这些过程相关的分子中间体是解偶联蛋白2(uncoupling protein 2, Ucp2),是线粒体转运蛋白超家族的成员。
通过检查腹侧海马(ventral hippocampal CA1 region, vCA1)的小胶质细胞-神经元相互作用,本研究发现vCA1具有典型的时间模式,即在明/暗周期的明亮期脊柱突触数量显著减少,伴随着小胶质细胞-突触接触增加和小胶质细胞吞噬包涵体数量增加。
随后,小胶质细胞产生ROS短暂增加,同时产生线粒体ROS的调节因子Ucp2表达增加。小胶质细胞条件性敲除Ucp2阻碍了脊柱突触的阶段性消除,导致ROS和溶酶体-脂滴复合物的积累,导致电生理学评估的海马神经元回路功能障碍,并改变焦虑样行为。
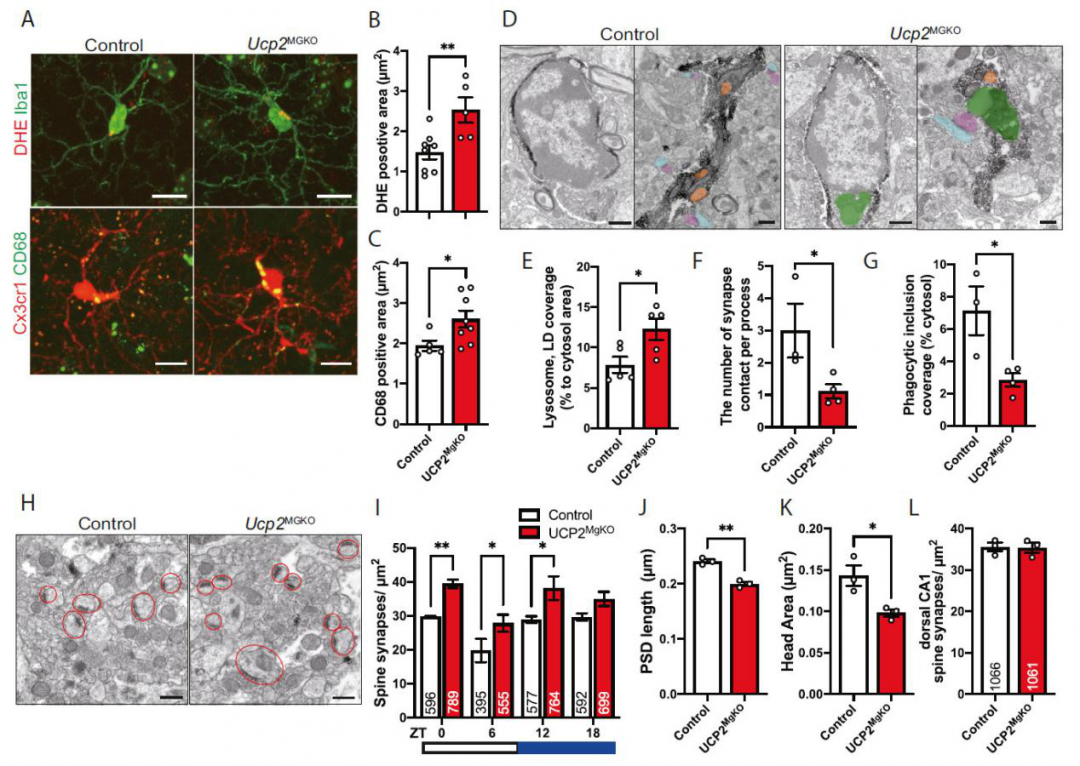 图.小胶质细胞选择性敲除Ucp2改变了vCA1的ROS产生、吞噬和突触数量
图.小胶质细胞选择性敲除Ucp2改变了vCA1的ROS产生、吞噬和突触数量
这些观察揭示了小胶质细胞和参与控制大脑功能的神经元之间的一种新颖且具有时代性的相互作用,可能为发现精神病和神经退行性疾病的新疗法开辟新的前景。
原文链接:
https://www.nature.com/articles/s41380-021-01105-1
来源:brainnews
原文链接:http://mp.weixin.qq.com/s?__biz=MzI2ODEyOTE3OQ==&mid=2649595170&idx=4&sn=85d7b96f71eb85b4d65fd9fcad64e651
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



