来源:BioArt
2型糖尿病在世界上已经成为一种流行性的代谢疾病,并且这种代谢疾病主要是由肥胖以及缺少运动引起的。2型糖尿病的表征主要是高血糖以及体内胰岛素不足【1】。而造成这些表征的原因则是胰岛B细胞功能紊乱【2】;B细胞去分化【3】以及B细胞凋亡和增殖比例失衡【4】。因此,如何更好地理解以上这些表现尤其是B细胞功能紊乱及凋亡背后的分子机理则更显重要。而且,更好的分子机理的研究也会为糖尿病的预防以及临床治疗提供新的方法和思路。
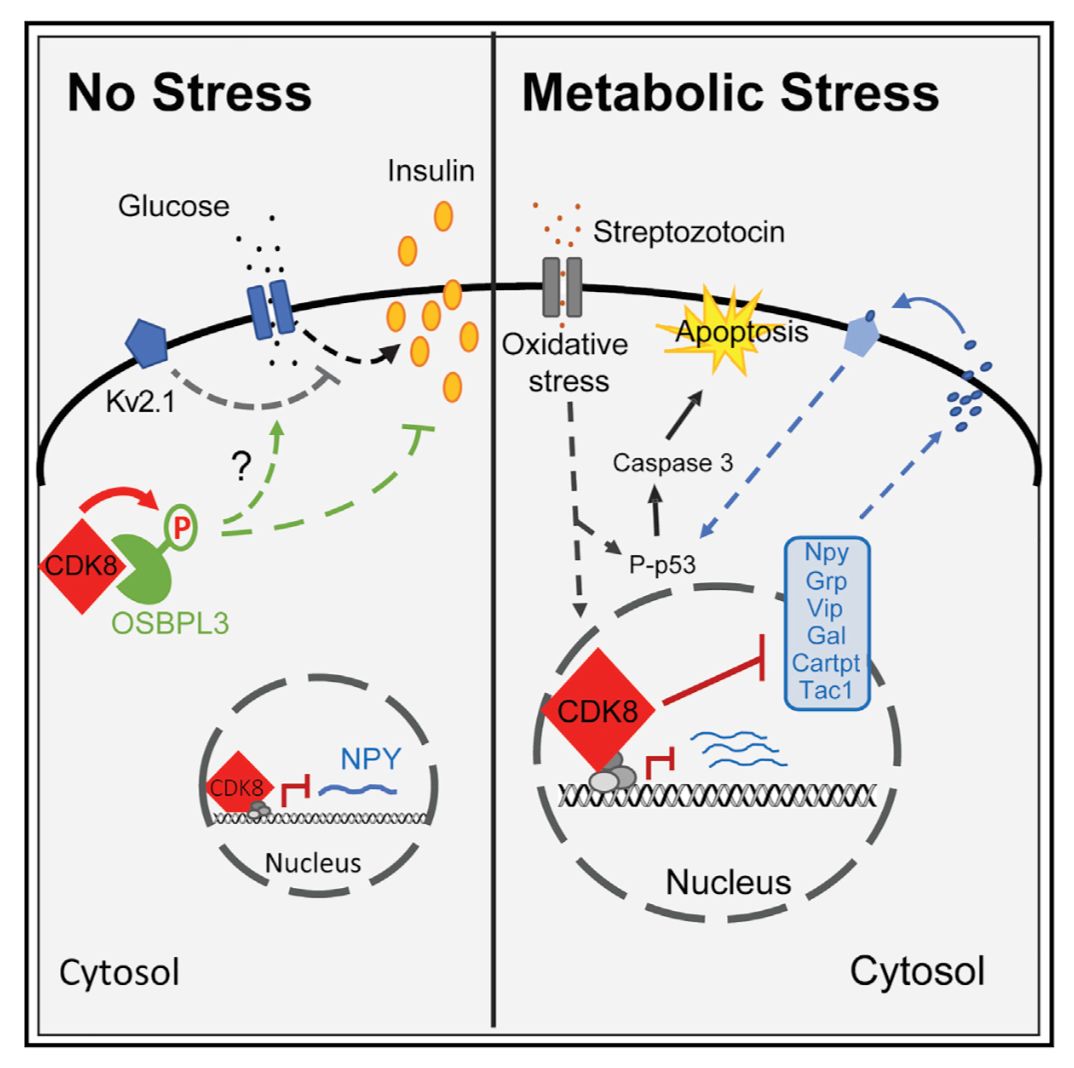
细胞周期依赖性蛋白激酶8(CDK8)是CDK家族的重要成员。其功能主要为调控细胞周期以及增强或者抑制众多下游基因表达。正因为其可以调控细胞周期,所以CDK8一直以来在癌症方面多有研究。人们发现,CDK8对乳腺癌,结肠癌,胃癌以及黑色素瘤均起到调控作用。因此CDK8是在癌症领域一直是一个重要的药物靶点【5】。然而尽管CDK8 在人类以及小鼠的胰岛B细胞中大量表达,其对B细胞功能以及增殖/凋亡的研究却依然缺失。
2019年9月10日,来自瑞士联邦理工学院(ETH)的Markus Stoffel 教授团队(第一作者为薛璟博士)在 Cell Reports 上发表题为 CDK8 Regulates InsulinSecretion and Mediates Postnatal and Stress-Induced Expression of Neuropeptidesin Pancreatic b Cells的论文,发现CDK8对胰岛B细胞的胰岛素分泌功能以及介导B细胞在发育及压力诱导条件下的一系列神经肽表达的调控。

作者在对CDK8在胰岛B细胞中特异性敲除的小鼠的代谢分析中发现,敲除鼠的葡萄糖耐受性以及胰岛素分泌显著提高,而敲除鼠的胰岛素灵敏度,高脂食物饲喂下的能量消耗,以及B细胞的增殖/凋亡则没有显著差异。
作者进而对CDK8如何调控B细胞胰岛素分泌的分子机理做了深入研究。通过磷酸化蛋白组学分析发现OSBPL3蛋白在CDK8敲除的胰岛B细胞中去磷酸化。而这种去磷酸化的程度在高浓度短时间葡萄糖刺激条件下尤为强烈。作者进一步在细胞系中进行了功能性验证,发现野生型OSBPL3对B细胞的胰岛素分泌有抑制作用,但是去磷酸化的OSBPL3却不能抑制胰岛素的分泌。综上,作者发现了调控B细胞胰岛素分泌功能的新模型:CDK8依赖型的OSBPL3磷酸化可以调节胰岛B细胞在葡萄糖刺激下的胰岛素分泌。
作者还对CDK8敲除的胰岛B细胞的转录本进行分析,发现神经肽Y(NPY)这种一般只在下丘脑中高表达的神经肽在CDK8敲除鼠的胰岛B细胞中大量异位表达。在胰岛B细胞的早期发育中(E15.5),NPY确实表达,但是在成年的B细胞中则保持沉默状态。但是在CDK8敲除的B细胞中,NPY却能维持高表达状态直至成年。
作者最后对CDK8敲除鼠进行代谢压力测试。通过注射链脲霉素(Streptozotocin)对小鼠体内的胰岛B细胞进行诱导凋亡。结果发现和对照鼠相比,CDK8敲除鼠的血糖以及胰岛B细胞凋亡增高,血液中的胰岛素水平更低,有着更严重的1型糖尿病的症状。通过对Streptozotocin注射的小鼠的胰岛B细胞的RNA测序分析,作者发现了一系列神经肽在CDK8敲除鼠的B细胞中表达上调。而这些神经肽则会对离体培养的小鼠胰岛B细胞造成更严重的细胞凋亡。
综上,作者通过构建CDK8在胰岛B细胞中特异性敲除的小鼠模型,发现了在生理以及代谢压力条件下,CDK8在胰岛B细胞功能以及存活方面的调控功能。CDK8缺失小鼠因为有着更高的胰岛素分泌,从而提高了葡萄糖耐受性。这种增强胰岛素分泌的功能则是由CDK8磷酸化OSBPL3进行介导的。作者进而发现CDK8敲除的胰岛B细胞会持续表达一系列神经肽,这些神经肽会进一步促进代谢压力下的胰岛B细胞的凋亡。
原文链接:
https://doi.org/10.1016/j.celrep.2019.08.025
参考文献
1. Alberti,K.G., and Zimmet, P.Z. (1998). Definition, diagnosis and classification ofdiabetes mellitus and its complications. Part 1: diagnosis and classificationof diabetes mellitus provisional report of a WHO consultation. Diabeticmedicine : a journal of the British Diabetic Association 15, 539-553.
2. Ashcroft,Frances M., and Rorsman, P. (2012). Diabetes Mellitus and the β Cell: TheLast Ten Years. Cell 148, 1160-1171.
3. Talchai, C.,Xuan, S., Lin, Hua V., Sussel, L., and Accili, D. (2012). Pancreatic betaCell Dedifferentiation as a Mechanism of Diabetic beta Cell Failure. Cell 150, 1223-1234.
5. Bouwens, L.,and Rooman, I. (2005). Regulation of Pancreatic Beta-Cell Mass. PhysiologicalReviews 85, 1255-1270.
4. Rzymski, T.,Mikula, M., Wiklik, K., and Brzozka, K. (2015). CDK8 kinase--An emerging targetin targeted cancer therapy. Biochimica et biophysica acta 1854, 1617-1629.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652475199&idx=7&sn=12d19ddc7972cf3231af0f1dd9fd8bf1&chksm=84e21c8bb395959dd3826aa2caf63122daec07f551fa64adf1eb5e9f0b19360207d8ea7d777a&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn