来源:BioArt
泛素化-蛋白酶体系统(Ubiquitin Proteasome System,UPS)是细胞内定向降解损伤和多余的可溶性蛋白的主要通路。它广泛参与到蛋白质量检测、细胞周期调控、免疫、应激反应以及神经发育和重构等多种过程中。底物蛋白在泛素化酶( E1 ubiquitin-activating enzyme, E2ubiquitin-conjugating enzyme 和 E3 ubiquitin ligase)的协同作用下被添加上多聚泛素化的标签,该标签被26S蛋白酶体(26S proteasome)所识别,从而被去折叠和降解成小肽。蛋白酶体的异常调控参与到众多严重人类疾病的发生过程中,比如神经退行性疾病、癌症和自身免疫疾病等。 近几年的生物物理(清华大学施一公教授、北京大学毛有东研究员、马克斯普朗克研究所Wolfgang Baumeister教授和加州大学伯克利分校Andreas Martin教授等实验室)和生物化学(哈佛大学Alfred Goldberg教授和Daniel Finley教授等实验室)研究大大推进了我们在分子水平对蛋白酶体工作原理的理解。然而,我们对蛋白酶体在细胞中的时空调控还知之甚少,比如它是如何定位到特定位置从而增强局部的蛋白降解能力的,它是如何与细胞的应激反应通路相偶联从而应对上升的蛋白降解需求的。尽管这些基础的问题对每个细胞都非常重要,但是神经元细胞对这些问题更加敏感。神经元一般有着极长的轴突和非常复杂的树突网络。蛋白酶体可以定位在神经元的末梢并发挥着不可或缺的作用,而它的合成和组装却发生在胞体。因此,如何把蛋白酶体在胞体和末梢之间快速的运输从而实现蛋白降解能力的灵活分配是神经元面临的一个基础挑战。 2019年7月18日,美国洛克菲勒大学Hermann Steller教授实验室的刘凯博士等在Developmental Cell 杂志上发表题为PI31 Is an Adaptor Protein for ProteasomeTransport in Axonsand Requiredfor Synaptic Development 的文章,对上述问题给出了答案。 他们发现,一个保守的蛋白酶体结合蛋白PI31,可以作为适配蛋白(adaptor protein)将蛋白酶体和分子马达dynein组装在一起。PI31 和dynein轻链蛋白直接相互作用,有趣的是该相互作用可以被PI31的磷酸化加强。这个磷酸化是由应激反应中的核心激酶 p38 MAPK介导的。他们进一步的生物化学实验证明,如果敲除PI31或者将其磷酸化位点突变,蛋白酶体和dynein之间就无法有效的形成复合体(图1)。采用活体追踪成像技术,他们证明,在果蝇运动神经元和小鼠海马神经元里,PI31及其磷酸化对蛋白酶体在轴突中的运输是必需的。通过对轴突和突触结构和功能的研究,他们进一步发现,如果PI31介导的蛋白酶体的转运功能下降,会导致轴突和突触的蛋白降解受阻,进而导致突触结构和功能的异常(图2)。
他们发现,一个保守的蛋白酶体结合蛋白PI31,可以作为适配蛋白(adaptor protein)将蛋白酶体和分子马达dynein组装在一起。PI31 和dynein轻链蛋白直接相互作用,有趣的是该相互作用可以被PI31的磷酸化加强。这个磷酸化是由应激反应中的核心激酶 p38 MAPK介导的。他们进一步的生物化学实验证明,如果敲除PI31或者将其磷酸化位点突变,蛋白酶体和dynein之间就无法有效的形成复合体(图1)。采用活体追踪成像技术,他们证明,在果蝇运动神经元和小鼠海马神经元里,PI31及其磷酸化对蛋白酶体在轴突中的运输是必需的。通过对轴突和突触结构和功能的研究,他们进一步发现,如果PI31介导的蛋白酶体的转运功能下降,会导致轴突和突触的蛋白降解受阻,进而导致突触结构和功能的异常(图2)。 图1. PI31 作为适配蛋白介导蛋白酶体-dynein分子马达复合体的形成。
图1. PI31 作为适配蛋白介导蛋白酶体-dynein分子马达复合体的形成。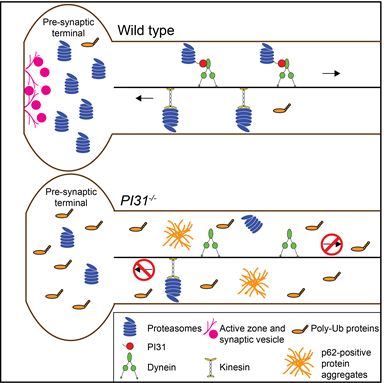 图2. PI31介导的蛋白酶体转运对神经元末梢的蛋白降解和突触的结构功能起到不可或缺的作用。PI31的失活会导致蛋白酶体无法正常转运,从而造成蛋白酶体底物在神经元末梢的聚集以及突触结构和功能的缺陷。 该研究具有重要的基础和转化意义。蛋白酶体转运适配蛋白的发现阐明了细胞是如何快速而特异的移动蛋白酶体从而实现蛋白降解能力的合理调配的。PI31 磷酸化在该过程中起到分子开关的作用。该分子开关受到应激通路的直接调控从而控制转运复合体的形成。这一发现将蛋白酶体的转运和外界刺激联系在一起,阐明了细胞应对外界压力、保持蛋白质组稳定的一种新途径。PI31 及其相互作用蛋白(Fbxo7和VCP/p97)的基因突变已经在人神经退行性疾病中发现,包括阿尔兹海默症(Alzheimer'sdisease, AD)、帕金森氏症(Parkinson'sdisease,PD)和肌萎缩性脊髓侧索硬化症(Amyotrophic lateral sclerosis,ALS),因此PI31介导的蛋白酶体转运的缺陷可能对这些疾病的发生有重要的贡献。蛋白酶体转运适配蛋白的发现也给我们提供了特异性控制蛋白酶体分布和提高局部蛋白降解能力的方法,有很大的潜力被应用于恢复和增强神经退行性疾病中神经元末梢的蛋白降解能力。 原文链接:https://doi.org/10.1016/j.devcel.2019.06.009制版人:小娴子
图2. PI31介导的蛋白酶体转运对神经元末梢的蛋白降解和突触的结构功能起到不可或缺的作用。PI31的失活会导致蛋白酶体无法正常转运,从而造成蛋白酶体底物在神经元末梢的聚集以及突触结构和功能的缺陷。 该研究具有重要的基础和转化意义。蛋白酶体转运适配蛋白的发现阐明了细胞是如何快速而特异的移动蛋白酶体从而实现蛋白降解能力的合理调配的。PI31 磷酸化在该过程中起到分子开关的作用。该分子开关受到应激通路的直接调控从而控制转运复合体的形成。这一发现将蛋白酶体的转运和外界刺激联系在一起,阐明了细胞应对外界压力、保持蛋白质组稳定的一种新途径。PI31 及其相互作用蛋白(Fbxo7和VCP/p97)的基因突变已经在人神经退行性疾病中发现,包括阿尔兹海默症(Alzheimer'sdisease, AD)、帕金森氏症(Parkinson'sdisease,PD)和肌萎缩性脊髓侧索硬化症(Amyotrophic lateral sclerosis,ALS),因此PI31介导的蛋白酶体转运的缺陷可能对这些疾病的发生有重要的贡献。蛋白酶体转运适配蛋白的发现也给我们提供了特异性控制蛋白酶体分布和提高局部蛋白降解能力的方法,有很大的潜力被应用于恢复和增强神经退行性疾病中神经元末梢的蛋白降解能力。 原文链接:https://doi.org/10.1016/j.devcel.2019.06.009制版人:小娴子来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652473462&idx=5&sn=1f64c6e56e069b85e00c726808630ea4&chksm=84e21bc2b39592d4c0982cf9661fcdef5b96d800c4a58b964e5e6aa9a57700f8456d2f4c790d&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



