内容来源:中国科学院
近期,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)研究员丛尧课题组与国家蛋白质科学研究(上海)设施质谱系统博士彭超合作,在Nature Communications上,在线发表题为Cryo-EM of mammalian PA28αβ-iCP immunoproteasome reveals a distinct mechanism of proteasome activation by PA28αβ的研究论文。该研究首次解析了哺乳动物PA28αβ-iCP免疫蛋白酶体的高分辨率冷冻电镜结构,揭示了激活因子PA28αβ结合并激活免疫蛋白酶体的独特分子机制,为深入理解免疫蛋白酶体的底物降解机制提供了结构基础。
真核细胞中的蛋白质降解超大分子机器——蛋白酶体参与调控诸多的生物进程,其功能异常与癌症、神经退行性疾病、免疫疾病等密切相关。免疫蛋白酶体是可调控炎症因子、参与MHC-I抗原提呈路径的一类特殊蛋白酶体,已在包括恶性肿瘤、自身免疫和炎性疾病等疾病中检测到免疫蛋白酶体的过表达。执行底物降解的蛋白酶体核心颗粒(CP)的活性受到可结合在其末端的一系列激活因子的调控。激活因子PA28αβ通过与免疫蛋白酶体核心颗粒(iCP)结合,以调节可能产生的抗原肽的模式,在MHC-I类抗原呈递中发挥重要作用。然而,由于PA28αβ-iCP复合体的动态性及易解离性等,至今尚无哺乳动物PA28αβ-iCP免疫蛋白酶体的完整结构。因此,PA28αβ如何激活免疫蛋白酶体进而调控底物降解的分子机制亟待阐明。
该研究中,研究人员首次解析出哺乳动物PA28αβ-iCP及iCP免疫蛋白酶体的近原子分辨率冷冻电镜结构(图A)。结合交联质谱分析,揭示了PA28αβ与iCP的相对空间排布(图B)。PA28αβ-iCP结构显示,PA28αβ稍微向iCP环的α3-α4亚基一侧倾斜,干扰了关键门控亚基α2/3/4的变构调节网络,导致iCP门控部分打开。研究发现,异源七聚体PA28αβ对iCP的结合和激活机制与同源七聚体TbPA26及PfPA28,或19S对CP的结合和激活机制相关但不同,这表明蛋白酶体核心颗粒已进化到足够复杂,可使用同一套变构网络从多种激活因子中获取并协调各种降解信号,精准调控蛋白酶体降解的底物及产物类型,进而参与各种复杂的生理过程。该研究提出,非ATP依赖的激活因子PA28αβ可能通过与iCP结合/解离的模式(on-and-off mode)来调节iCP门控的打开和关闭及底物降解,该机制可能被其他非ATP依赖的蛋白酶体激活因子采用。因此,在进化过程中,激活因子的生理功能及底物的复杂性决定蛋白酶体激活因子的结构复杂性和CP的门控调控机制。此外,该研究还发现,在免疫催化亚基和普通催化亚之间的保守差异,有助于阐明普通蛋白酶体与免疫蛋白酶体的酶活差异,为发展免疫特异性抑制剂提供分子基础。
该研究首次解析了哺乳动物PA28αβ-iCP的完整结构,揭示了PA28αβ激活免疫蛋白酶体的分子机制,为深入理解PA28αβ调控免疫蛋白酶体底物降解机制及发展免疫蛋白酶体抑制剂提供了重要结构基础。丛尧组博士陈进寰、博士研究生汪一帆和徐聪为论文的共同第一作者,丛尧、分子细胞卓越中心博士后丁占玉、彭超为论文的共同通讯作者。研究工作得到国家自然科学基金委、科学技术部、中科院和上海市科委等的支持,获得国家蛋白质科学研究(上海)设施的冷冻电镜系统、质谱系统、数据库与计算分析系统及蛋白质表达纯化系统的帮助。
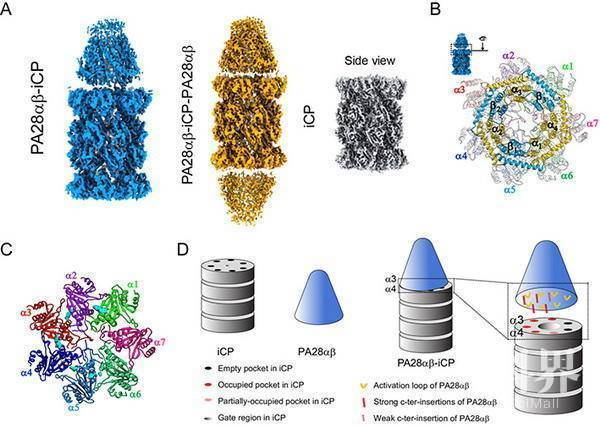 (A)免疫蛋白酶体PA28αβ-iCP及iCP的冷冻电镜结构,PA28αβ即可结合在iCP的一端,也可两端同时结合;(B)PA28αβ与iCP的相对空间排布;(C)PA28αβ-iCP复合体中PA28αβ与iCP的相互作用界面,其中,插入iCP环的PA28αβ的C末端尾巴由青色密度表示;(D)PA28αβ结合并激活iCP的分子机制示意图
(A)免疫蛋白酶体PA28αβ-iCP及iCP的冷冻电镜结构,PA28αβ即可结合在iCP的一端,也可两端同时结合;(B)PA28αβ与iCP的相对空间排布;(C)PA28αβ-iCP复合体中PA28αβ与iCP的相互作用界面,其中,插入iCP环的PA28αβ的C末端尾巴由青色密度表示;(D)PA28αβ结合并激活iCP的分子机制示意图
原文链接:http://www.cas.cn/syky/202102/t20210210_4777922.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn