来源:精准医学与蛋白组学
主要结论:mTORC1下游转录因子TFEB参与病毒非溶解性释放过程。
人体肠道内丰富多样的病毒构成了人体的肠道病毒组,是人体微生物组的重要组成部分。人肠道病毒会引起各种传染性疾病,如手足口病、脑炎、心肌炎和肺炎等,严重威胁人体健康。肠道病毒通常被称为溶血性病毒,而在宿主细胞死亡和裂解之前,肠道病毒的非溶解性释放机制尚不清楚。过去肠道病毒感染的研究集中在少数选定的宿主蛋白上,可能会造成很多潜在重要信息的忽视,无法对肠道病毒感染宿主细胞的整个过程进行全面的分析,从而限制了我们对肠道病毒的致病机理及治疗肠道病毒感染的全面认识。
近日,来自荷兰的研究人员在国际期刊Nature Communications(IF=12.121)上发表了关于肠道病毒感染宿主细胞过程的重要研究成果。研究人员利用蛋白质组学和磷酸化组学的手段,全面监测了6个不同时间点肠道病毒CVB3感染人体细胞动态过程,发现了调控此过程关键调控激酶及其mTORC1信号通路活性降低。通过功能实验进一步发现,mTORC1下游转录因子TFEB参与病毒非溶解性释放的过程。此研究为进一步解析肠道病毒的致病机理,及开发新的肠道病毒抑制剂和治疗肠道病毒感染提供了重要的实验证据。  一、定量蛋白质组和磷酸化组研究策略
一、定量蛋白质组和磷酸化组研究策略
研究者首先收集了18个(6个时间点,3个生物复制品)肠道病毒感染宿主的细胞样本(样本策略),运用基于Label free的蛋白质组学和磷酸化组学定量技术(质谱策略)进行了分析。蛋白质组学研究共鉴定到6,466个蛋白质,而在每个时间点大约定量到3,500个蛋白质,总计3,202个定量蛋白质在所有样本中均被定量到。磷酸化蛋白质组学研究共鉴定到来源大于3,500个蛋白的大于14,000个磷酸化位点(除10h样品外)。
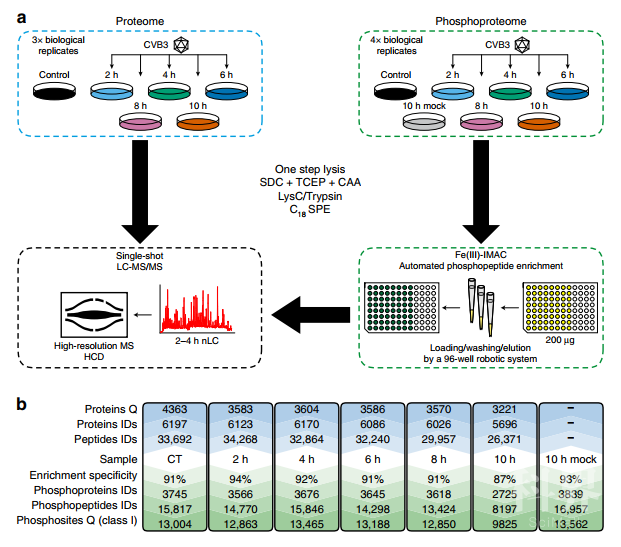 图1 蛋白质组学和磷酸化组学研究策略
图1 蛋白质组学和磷酸化组学研究策略
二、磷酸化蛋白质组功能分析及激酶预测
接下来,研究者对不同的差异蛋白绘制了聚类热图,发现587种差异蛋白随着感染的进展表达量降低,而211种差异蛋白随着感染时间的推移表达量升高(图2a)。同样,研究者对14,371个CVB3调节的差异磷酸化位点进行了聚类热图分析,发现其可被明显区分为三类,磷酸化上调、感染期间磷酸化增加后降低、和感染期间磷酸化下调(图2b)。通过上游激酶预测分析,发现AGC、CMGC、CAMK和CK1等参与调控肠病毒感染宿主的过程(图2c)。此外,结合蛋白质组和磷酸化组学数据对重要信号通路分析,发现涉及凋亡或转录/翻译的途径被显著富集,其次为PI3K/AKT/mTOR和MAPK级联信号通路。
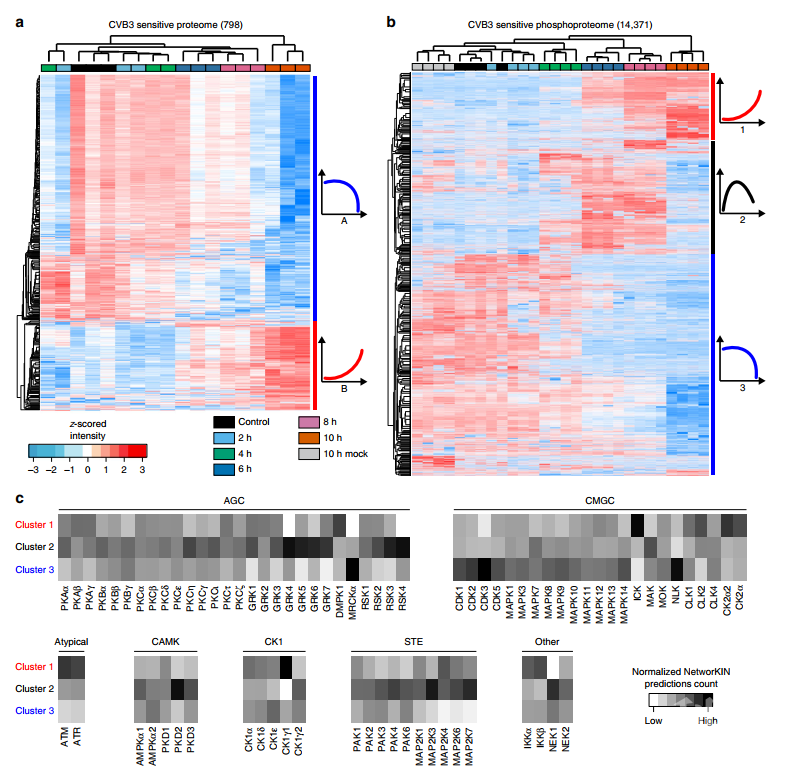 图2 蛋白质组和磷酸化组学数据的功能分析及激酶预测
图2 蛋白质组和磷酸化组学数据的功能分析及激酶预测
三、CVB3感染细胞中mTORC1信号通路的磷酸化事件
基于mTORC1信号通路在调节细胞代谢、生长、增殖和生存中起着重要作用,所以研究者重点对mTORC1信号通路进行了研究。首先,研究者对调控mTORC1的上游几条信号通路(Akt1-TSC1/2,p90S6K,AMPK和MAPK8)进行了深入分析。发现Akt1-TSC1/2信号通路的Akt1 S124及TSC2 S981的磷酸化水平下调,并且抑制mTORC1活性的PRAS40 T246的磷酸化水平也下调。同样对p90S6K,AMPK和MAPK8的调节mTORC1活性的关键蛋白的重要磷酸化位点进行了分析,发现它们对mTORC1的信号起抑制作用。然后,研究者对mTORC1信号通路下游基因进行了分析,发现下游ULK1、P70、4E-BP和TFEB磷酸化修饰水平也整体下调。以上结果表明,在肠道病毒感染宿主细胞的过程中,mTORC1信号通路活性降低。
 图3 CVB3感染细胞中mTORC1信号通路的磷酸化事件 最后,研究者通过Western Blot实验对mTORC1信号通路的重要蛋白的磷酸化组学进行了验证,与磷酸化组学数据一致。并且,发现了mTORC1下游转录因子TFEB可介导细胞外囊泡而影响病毒释放的过程。
图3 CVB3感染细胞中mTORC1信号通路的磷酸化事件 最后,研究者通过Western Blot实验对mTORC1信号通路的重要蛋白的磷酸化组学进行了验证,与磷酸化组学数据一致。并且,发现了mTORC1下游转录因子TFEB可介导细胞外囊泡而影响病毒释放的过程。
综上所述,本研究利用蛋白质组学和磷酸化写实组学的手段,监测了肠病毒感染宿主的动态调控过程,发现了关键调控激酶及mTORC1信号通路活性降低,并且发现mTORC1下游转录因子TFEB影响病毒释放的过程。该研究为开发新的肠道病毒抑制剂,更好地治疗肠道病毒感染提供了重要的指导意义。
 一、定量蛋白质组和磷酸化组研究策略
一、定量蛋白质组和磷酸化组研究策略研究者首先收集了18个(6个时间点,3个生物复制品)肠道病毒感染宿主的细胞样本(样本策略),运用基于Label free的蛋白质组学和磷酸化组学定量技术(质谱策略)进行了分析。蛋白质组学研究共鉴定到6,466个蛋白质,而在每个时间点大约定量到3,500个蛋白质,总计3,202个定量蛋白质在所有样本中均被定量到。磷酸化蛋白质组学研究共鉴定到来源大于3,500个蛋白的大于14,000个磷酸化位点(除10h样品外)。
 图1 蛋白质组学和磷酸化组学研究策略
图1 蛋白质组学和磷酸化组学研究策略二、磷酸化蛋白质组功能分析及激酶预测
接下来,研究者对不同的差异蛋白绘制了聚类热图,发现587种差异蛋白随着感染的进展表达量降低,而211种差异蛋白随着感染时间的推移表达量升高(图2a)。同样,研究者对14,371个CVB3调节的差异磷酸化位点进行了聚类热图分析,发现其可被明显区分为三类,磷酸化上调、感染期间磷酸化增加后降低、和感染期间磷酸化下调(图2b)。通过上游激酶预测分析,发现AGC、CMGC、CAMK和CK1等参与调控肠病毒感染宿主的过程(图2c)。此外,结合蛋白质组和磷酸化组学数据对重要信号通路分析,发现涉及凋亡或转录/翻译的途径被显著富集,其次为PI3K/AKT/mTOR和MAPK级联信号通路。
 图2 蛋白质组和磷酸化组学数据的功能分析及激酶预测
图2 蛋白质组和磷酸化组学数据的功能分析及激酶预测三、CVB3感染细胞中mTORC1信号通路的磷酸化事件
基于mTORC1信号通路在调节细胞代谢、生长、增殖和生存中起着重要作用,所以研究者重点对mTORC1信号通路进行了研究。首先,研究者对调控mTORC1的上游几条信号通路(Akt1-TSC1/2,p90S6K,AMPK和MAPK8)进行了深入分析。发现Akt1-TSC1/2信号通路的Akt1 S124及TSC2 S981的磷酸化水平下调,并且抑制mTORC1活性的PRAS40 T246的磷酸化水平也下调。同样对p90S6K,AMPK和MAPK8的调节mTORC1活性的关键蛋白的重要磷酸化位点进行了分析,发现它们对mTORC1的信号起抑制作用。然后,研究者对mTORC1信号通路下游基因进行了分析,发现下游ULK1、P70、4E-BP和TFEB磷酸化修饰水平也整体下调。以上结果表明,在肠道病毒感染宿主细胞的过程中,mTORC1信号通路活性降低。
 图3 CVB3感染细胞中mTORC1信号通路的磷酸化事件 最后,研究者通过Western Blot实验对mTORC1信号通路的重要蛋白的磷酸化组学进行了验证,与磷酸化组学数据一致。并且,发现了mTORC1下游转录因子TFEB可介导细胞外囊泡而影响病毒释放的过程。
图3 CVB3感染细胞中mTORC1信号通路的磷酸化事件 最后,研究者通过Western Blot实验对mTORC1信号通路的重要蛋白的磷酸化组学进行了验证,与磷酸化组学数据一致。并且,发现了mTORC1下游转录因子TFEB可介导细胞外囊泡而影响病毒释放的过程。综上所述,本研究利用蛋白质组学和磷酸化写实组学的手段,监测了肠病毒感染宿主的动态调控过程,发现了关键调控激酶及mTORC1信号通路活性降低,并且发现mTORC1下游转录因子TFEB影响病毒释放的过程。该研究为开发新的肠道病毒抑制剂,更好地治疗肠道病毒感染提供了重要的指导意义。
参考文献:1. Giansanti P, et al., 2020. Dynamic remodelling of the human hostcell proteome and phosphoproteome upon enterovirus infection. Nature Communications.
来源:ptm-biolab 精准医学与蛋白组学
原文链接:https://mp.weixin.qq.com/s?__biz=MjM5NDM5NjQxOA==&mid=2650450728&idx=1&sn=63835cf480f7f6408bb4c0eab646ba93&chksm=be866b4589f1e253dda410e295a605cfdf60ddd1e6b1f139b8e890bd8e2d0d83eb52d6c6cb80#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn