来源:中科院之声
近日,中国科学院精密测量科学与技术创新研究院理论与计算化学组副研究员段谟杰等利用计算模拟方法及增强采样技术,揭示磷酸化修饰对固有无序KID结构及其与KIX蛋白结合过程的调控机制。
磷酸化修饰是生物体内常见的一种翻译后修饰,在调控信号转导及细胞生长和凋亡等过程中发挥重要作用。较多磷酸化位点位于固有无序蛋白或无序蛋白区域上。这些蛋白的高度动态及伸展特性使其较易被化学修饰。同时,诸如磷酸化等翻译后修饰能够改变和调控固有无序蛋白的结构和功能。作为一个模型体系,激酶诱导结构域KID在被磷酸化修饰之后,与转录共激活蛋白CBP上的KIX结构域结合并调控目标基因的表达。由于固有无序蛋白结构的高度动态性,因此,学界目前仍缺乏关于单个位点上磷酸化修饰如何能够高效调控KID与KIX结合的分子机制这一问题的合理解释。
分子动力学模拟借助理论计算手段,能够从原子水平上观测和获取蛋白质结构变化。为能够得到KID结构变化及与KIX结合过程,研究人员借助增强采样技术,得到KID-KIX结合过程的自由能变化。结果表明,磷酸化导致的蛋白质上电荷分布及静电相互作用变化并非是导致结合能力改变的直接原因。在磷酸化之后,在pKID蛋白上面形成由疏水残基组成的疏水团簇(HRC),其高度的疏水性驱使KID与KIX上的芳香族残基酪氨酸相互作用,并进一步引导pKID完成结合及折叠过程。该研究揭示KID与KIX结合的分子机制,为磷酸化修饰调控蛋白质的结构和功能提供新思路。
相关研究成果发表在《通讯-化学》(Communications Chemistry)上,该研究选入自然出版网站上的“behind the paper”频道,发表post进一步阐述。博士研究生刘娜、郭玥为论文的共同第一作者,段谟杰为论文通讯作者。研究工作得到国家自然科学基金的资助。
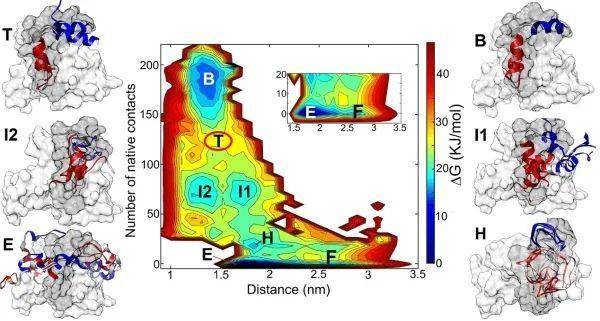
磷酸化之后的pKID与KIX结合过程的自由能变化图。从未结合的自由态(F态)到完全结合态(B态),需要经过一系列关键中间态,中间态的结构特征表明pKID上形成的特定疏水团簇结构(HRC)对于蛋白结合具有决定作用
来源:zkyzswx 中科院之声
原文链接:https://mp.weixin.qq.com/s?__biz=MjM5NzIyNDI1Mw==&mid=2651782657&idx=4&sn=cd57cb25b9ddfffb311c0ccd0c5c38fb&chksm=bd2714538a509d457fe323be468ad4587f76e29dff115082266a8a7753dcc1a4042101685ea7#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


