来源:高分子科学前沿
蛋白质-蛋白质相互作用(protein–proteininteractions, PPI)在多种生命系统中起到了至关重要的作用。若能实现对蛋白质-蛋白质相互作用的精确控制,我们将可能发展出一套高效低副作用的方法来系统性地操控生物行为。
自2009年以来,东京大学相田卓三教授课题组报道了一系列多位点胍离子修饰的“分子胶水”。这些末端带有胍离子的树枝状大分子不仅可以构建多种超分子自组装结构(J. Am. Chem. Soc. 2009, 131,1626–1627),更能通过黏附蛋白质,核酸的活性位点而暂时阻断其生物活性(Angew. Chem. Int. Ed.2010, 49, 3030 –3033)。通过进一步设计功能性的“分子胶水”,可以利用三磷酸腺苷(ATP)选择性激活胰岛素(J.Am. Chem. Soc., 2016, 138, 5527–5530),或实现细胞内siRNA的释放(J.Am. Chem. Soc., 2019, 141, 2862–2866)。
最近,相田卓三教授团队更进一步,设计了一种可光裂解的胍离子树枝状“分子胶水” PCGlue-NBD。它可在紫外光的驱动下调控蛋白质-蛋白质相互作用,进而在时间和空间上控制细胞的迁移行为(J. Am. Chem. Soc. DOI:10.1021/jacs.9b02427)。
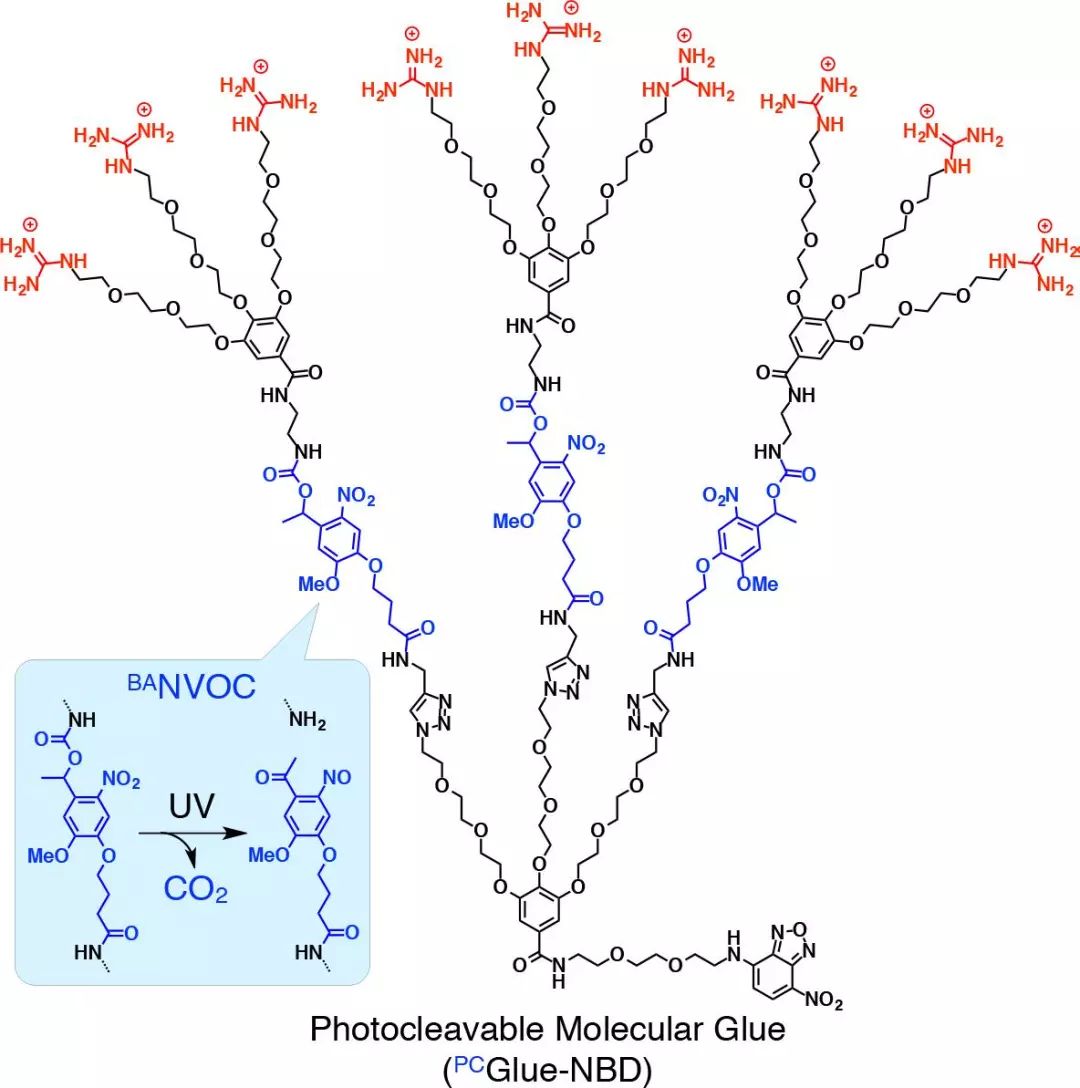
图1. 可光裂解的“分子胶水”PCGlue-NBD
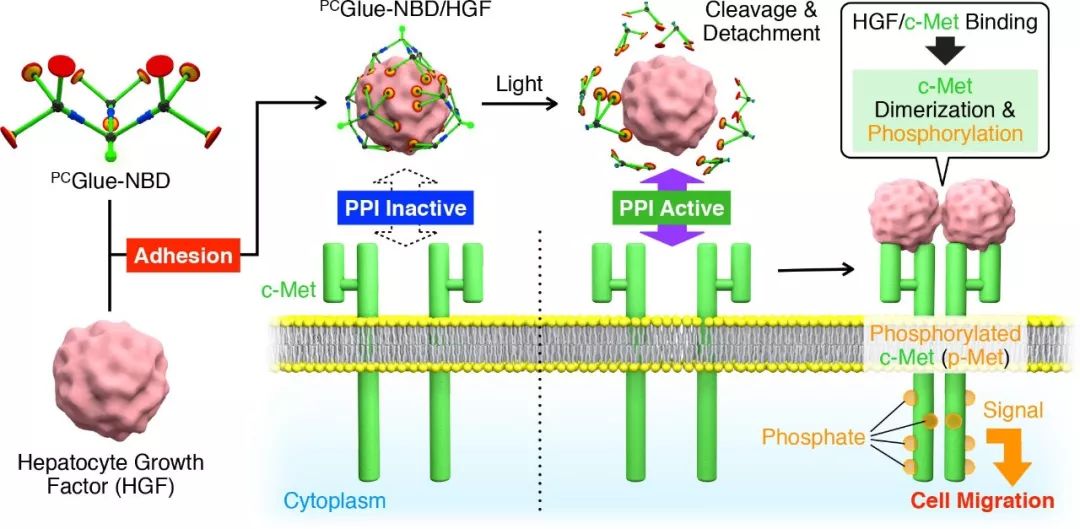 图2. PCGlue-NBD调控蛋白质-蛋白质相互作用的机理
图2. PCGlue-NBD调控蛋白质-蛋白质相互作用的机理
PCGlue-NBD可以吸附在肝细胞生长因子(Hepatocyte growth factor, HGF)表面而使其暂时失去与其受体c-Met的结合能力。这一蛋白质-蛋白质相互作用在细胞增殖,存活和迁移过程中起着重要作用,同时也能促进伤口的愈合过程。在本研究中,紫外光(365 nm)可以使PCGlue-NBD裂解而重新激活HGF与细胞表面c-Met的特异性结合。产生的HGF/c-Met复合体则进一步形成c-Met二聚体并通过磷酸化反应驱动细胞迁移。
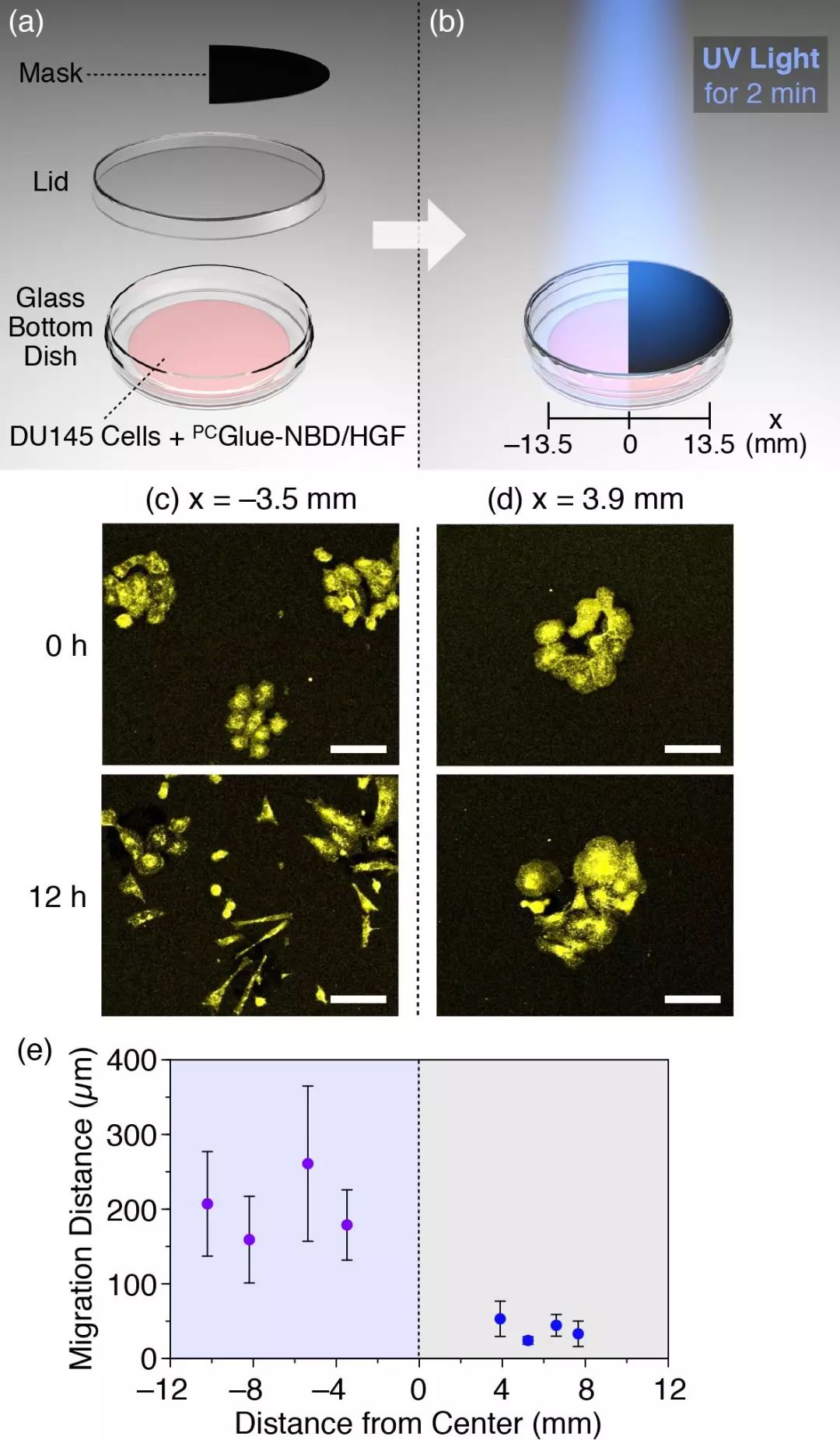
图3. 通过紫外光的曝光区域和时间可选择性调控细胞迁移。
通过设计可光裂解的“分子胶水”,相田卓三教授团队首次开发了可以“激活”蛋白质-蛋白质相互作用的阻断剂,并可以通过紫外光的曝光时间和曝光区域来选择性调节细胞迁移。此外,该“分子胶水”还可以被细胞吞入,因此细胞内的光调控蛋白质-蛋白质相互作用可作为该工具进一步运用的方向。
全文链接:
https://pubs.acs.org.ccindex.cn/doi/10.1021/jacs.9b02427
来源:Polymer-science 高分子科学前沿
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5NjM5NzA5OA==&mid=2651717526&idx=3&sn=a4208f63fe95c5e1177a600aa43533b7&chksm=8b49edd3bc3e64c5c5298afd373b0d775c4ae541522d62b5d3f8ecc5b0ff3080939360e3214e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


