来源:BioArt
撰文 | 黄蔚
责编丨迦溆
相比近年来大热的RNA m6A修饰,哺乳动物的DNA 6mA修饰直到近5年,才迎来自己的春天。
2016年,耶鲁大学的Andrew Z. Xiao教授在Nature发表研究,首次证明小鼠胚胎干细胞中存在6mA修饰【1】,回答了哺乳动物基因组中是否存在6mA修饰这个关键问题。此后,广州医科大学的晏光荣和肖传乐教授利用SMRT测序在人类基因组中鉴定到6mA修饰(Mol Cell丨晏光荣肖传乐等合作解码人类基因组新型甲基化修饰)【2】,谢琦博士等在Cell发表研究证明6mA参与癌症(神经胶质瘤)的进程,进一步揭示了6mA的生理功能(Cell丨谢琦博士等揭示DNA新修饰6mA在神经胶质瘤中的作用)【3】。
然而,关于6mA研究最基本的问题:甲基化酶、去甲基化酶和阅读蛋白分别是什么,目前尚存在争议以及研究空白。
Andrew Z. Xiao教授首次鉴定了ALKBH1作为6mA去甲基化酶,晏光荣和肖传乐教授则鉴定了N6AMT1作为6mA的甲基化酶,而谢琦博士等在神经胶质瘤的研究中发现 N6AMT1并不具有6mA甲基化酶活性,但ALKBH1具有去甲基化酶活性(该研究为谢琦博士与Jeremy N. rich和Andrew Z. Xiao共同发表)。
近日,南加州大学医学院的Douglas E. Feldman教授等在 Molecular Cell 发表了题为An Adversarial DNA N6-Methyladenine-Sensor Network Preserves Polycomb Silencing的研究论文,该研究首次证明METTL4和ALKBH4作为6mA的甲基化酶和去甲基化酶,并将去泛素化酶ASXL1和MPND鉴定为6mA的阅读蛋白(sensor)。

以下是文章解读:
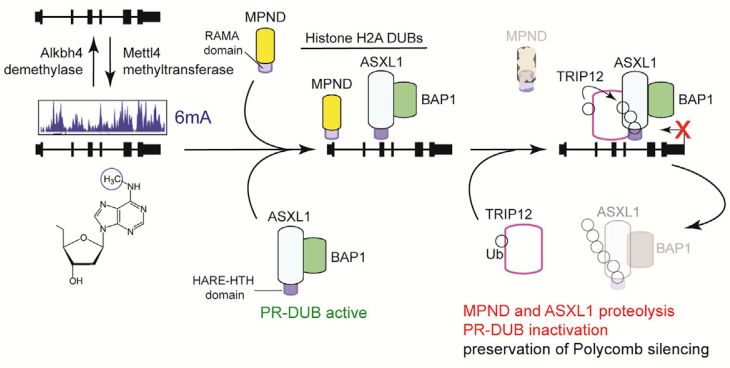
1. 研究者的思路主要是根据蛋白的保守性,在人类蛋白组中寻找与细菌6mA相关蛋白拥有同源结构的蛋白。METTL4和ALKBH4正是通过这样的策略鉴定到的,进一步的实验也发现它们具有甲基化酶和去甲基化酶活性。
2. 6mA是如何调控基因表达的呢?为了回答这个问题,研究者开始寻找6mA的阅读蛋白。同样根据蛋白的保守性,研究者发现蛋白ASXL1的HTH domain和蛋白MPND的 RAMA domain是细菌中结合6mA修饰的保守结构域,因此将ASXL1和MPND锁定为潜在的6mA阅读蛋白。Pull down实验证明ASXL1和MPND可以结合带有6mA修饰的DNA探针,提示它们是6mA阅读蛋白。
3. 那么,ASXL1结合6mA后,是如何影响带有6mA修饰的基因的表达呢?已有研究表明,6mA主要存在于异染色质区域,而异染色质的组蛋白修饰包括H3K27me3和H2A-Ub等。研究者意外地发现,敲低6mA甲基化酶METTL4显著提高H2A-Ub去泛素化酶ASX1L的表达,而H2A-Ub也明显降低。这提示METTL4有可能招募了ASX1L的水解酶。
确实,研究者发现METTL4促进E3泛素连接酶TRIP12与ASX1L的结合,提示6mA位点的异染色质标志物H2A-Ub的降低是由于敲低METTL4后,TRIP与ASX1L结合降低造成的。
总的来说,研究者通过以上实验得到如下6mA工作模型:METTL4和ALKBH4作为6mA的甲基化酶和去甲基化酶,调控DNA甲基化的丰度。ASXL1和MPND因识别6mA修饰而来到带有6mA修饰的基因附近,此时E3泛素连接酶TRIP12与ASXL1和MPND结合,造成它们的降解,使得该基因座位的H2A-Ub修饰得到保留,基因表达继续被抑制。这一机制也使得6mA在生长发育过程中扮演重要角色。
然而,遗憾的是,虽然研究者鉴定了两个新的6mA修饰酶,但是却未评价已鉴定的N6AMT1和ALKBH1的催化活性,因此,6mA是否由多个蛋白共同催化,这些催化酶是如何分工的,它们所识别的DNA motif是否相同,尚不得知。
此外,关于ASXL1和MPND对6mA的阅读,在编者看来这似乎是“自杀式阅读”:ASXL1和MPND阅读6mA后,促进了E3泛素连接酶TRIP12对它们的结合,导致了自身的降解。但是研究者仅证明了METTL4促进E3泛素连接酶TRIP12与ASXL1的结合,这似乎与ASXL1识别6mA修饰无关,6mA修饰本身能否促进ASXL1的降解,尚不清楚。
另外,有研究发现6mA与H3K9me3修饰存在明显的共定位【3】,是否有6mA的阅读蛋白促进了H3K9me3修饰,还有待进一步研究。
DNA 6mA的研究才刚开始,鉴于它在生长发育和癌症中的重要功能,相信未来会有更多人关注6mA,也会有更多研究为我们解开谜团。
原文链接:
https://doi.org/10.1016/j.molcel.2019.03.018
制版人:珂
参考文献
1. T. P. Wu, T. Wang, M. G. Seetinet al. DNA methylation on N(6)-adenine in mammalian embryonic stem cells. Nature,2016,532(7599):329-333
2. C. L. Xiao, S. Zhu, M. Heet al. N(6)-Methyladenine DNA Modification in the Human Genome. Mol Cell,2018,71(2):306-318
3. Xie, Q., Wu, T.P., Gimple, R.C., Li, Z., Prager, B.C., Wu, Q., Yu, Y., Wang, P.,Wang, Y., Gorkin, D.U., et al. (2018). N6-methyladenine DNA modification in glioblastoma. Cell 175, 1228–1243.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468771&idx=3&sn=283e439eb73b1afa7fa1b11de439dba3&chksm=84e2e597b3956c8194fff50c1dd696865f6d58ac2a567c54ba12610f53810566744f22887a78&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn