来源:药学进展
编者按:非酒精性脂肪性肝炎(NASH)是影响全球上亿人的一个重要健康问题,迄今为止尚无任何 FDA 批准的特效药物。令人振奋的是,2019 年见证了 NASH 新药发现和开发方面的进步,FDA 有望在 2020 年批准首个 NASH 新药。《药学进展》与中国 NASH 新药联盟、药时代携手合作,开辟 NASH 专栏,旨在汇聚行业专家智慧,报道 NASH 最新研究进展,探讨高效开发新药的战略战术,提升中国 NASH 新药研发的整体水平,以推动和加快 NASH 新药的研发上市,惠及中国及全球患者。
专家介绍:王建华
医学博士。1998 年作为中法医学交流博士后赴法国国家健康和医学研究院(INSERUM),开展慢性肝病和门脉高压临床和基础研究。2001 年转到澳大利亚悉尼大学 Westmead 研究院工作,之后晋升为助理教授。在悉尼大学带领自己的研究团队,申请澳洲国家课题,发表高影响因子 SCI 论文,指导和培养博士 / 博士后多名。2011 年共同组建澳中医学交流协会并担任第一届会长。一直和国内科研 / 药物研发机构密切合作开发新药项目,获 2012 年教育部春晖创业大赛奖。2013 年加入中国诺华研发中心担任生物研发副主任,负责多项肝病创新药研发,同时建立了国际高水平的肝脏新药研发平台。2015 年转到药明康德新药研发部,担任执行总监职位,负责相关疾病新药研发的立项、生物和医学方面研究。在多年研发经历中,承担并协助过 50 多项Ⅰ类创新药开发,包括肝病、代谢、炎症、免疫、肿瘤、肺病、心血管、肾脏和眼科等疾病相关靶点项目。其中的 20 多个新药项目处于临床阶段。2019 年初加入博济医药任首席运营官,负责公司运营和创新药部门管理。2019 年 7 月被推举为第一届中国脂肪肝新药联盟主席。共发表科学论文 40 余篇。
正文
肝脏非实质细胞在非酒精性脂肪性肝炎中的作用研究进展
高文,王建华 *(广州博济医药生物技术股份有限公司,广东 广州 510640)[摘要]非酒精性脂肪性肝病是全球最流行的肝脏疾病,其疾病谱包含非酒精性脂肪肝、非酒精性脂肪性肝炎、与非酒精性脂肪性肝炎相关的纤维化、肝硬化和肝细胞癌。非酒精性脂肪性肝炎是非酒精性脂肪性肝病进展性的肝脏病理表征,临床上需要药物治疗或其他治疗方式干预,但目前全球尚无针对非酒精性脂肪性肝炎的药物获批上市。非酒精性脂肪性肝炎发病机制复杂,涉及多种细胞内、细胞间的交互作用以及复杂的分子信号通路。非酒精性脂肪性肝炎治疗是一个尚未被满足的巨大临床需求。综述了肝脏中几种主要的非实质细胞在非酒精性脂肪性肝炎发病中的重要作用,同时探讨了非酒精性脂肪性肝炎药物开发靶点与不同细胞之间的相关性。
非酒精性脂肪性肝病(NAFLD)是指除酒精、药物、病毒感染等其他明确的肝损伤因素外的原因所导致的以肝细胞内脂肪过度沉积为主要特征的临床综合征,包括非酒精性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH),以及与 NASH 相关的肝纤维化、肝硬化和肝细胞癌。NAFLD 通常由代谢综合征引起,与肥胖和胰岛素抵抗(IR)、2 型糖尿病和异常血脂症密切相关。从经典的“二次打击”学说到现在的“多次打击”学说,NAFLD 的具体发病机制尚未完全阐述清楚,但可以明确的是 NAFLD发病的第一步是肝脏脂肪堆积。从病理生理学角度来看,内脏脂肪组织脂解增加、肝脏新生脂肪活化和高热量高脂肪饮食被认为是肝细胞脂质过多积聚的主要来源。有文献报道,肝脏中大约 60% 的游离脂肪酸(FFA)来源于脂肪组织,25% 来源于脂肪从头合成(DNL),15% 来自于饮食和其他。单纯性脂肪变性被认为是一种良性的疾病,但 NASH有较高风险发展为肝硬化和肝癌。从单纯性脂肪变性到 NASH 是一个复杂的疾病发展过程,涉及到肝细胞、肝脏非实质细胞和其他组织细胞,包括内脏脂肪组织和肠道。肝细胞凋亡及多种细胞因子通过激活 Kupffer 细胞招募单核细胞和白细胞,促进炎症和肝星状细胞(HSC)的活化、细胞外基质(ECM)过度合成和沉积进而发展为肝纤维化。近年来的研究进展已逐渐明确 NASH 阶段与肝脏恶化进展的相关性,因此围绕 NASH 的机制研究以及新药开发逐渐成为当前肝病领域的研究热点。本文重点总结了几种主要的肝脏非实质细胞在NASH 发病进展中的重要作用,旨在帮助读者更全面理解 NASH 发病机制的复杂性,期望对治疗新靶点的探索和新药开发提供参考。
1肝脏不同细胞在非酒精性脂肪性肝炎发病中 发挥的重要角色肝脏细胞主要由实质细胞和非实质细胞组成,其中实质细胞约占肝脏细胞的 65%,非实质细胞主要包括肝窦状内皮细胞(LSEC)、Kupffer 细胞、HSC 以及淋巴细胞等。肝细胞是肝脏实质中的一类多边形的腺上皮细胞。肝实质细胞是肝脏行使其功能的主要细胞 , 执行着许多重要的功能 , 如毒物的分解、尿素的合成、制造血浆中除几种免疫球蛋白之外的所有血浆蛋白质等。肝脏脂肪变性主要表现为肝细胞胞质内的脂肪堆积。肝非实质细胞是指不具有肝脏特有功能的细胞,这些细胞的功能主要是具有连接和支撑肝实质细胞的作用。LSEC是一种高度分化的内皮细胞,约占肝脏细胞总数的10%。LSEC 具有独特的表型,缺乏基底膜,并且有许多筛孔,是血液与肝的双向物质交换的主要调节因子。肝巨噬细胞是贮留在肝脏的巨噬细胞,占全身组织巨噬细胞的 80% 以上,其中最具代表性的是 Kupffer 细胞。Kupffer 细胞是流动性极高的肝巨噬细胞,位于血窦内皮侧,占肝脏细胞总数的 15%,其主要功能是吞噬和递呈肝循环中的病原体、细胞碎片和细菌衍生产物等,可使体内微环境维持低水平且平衡的炎症水平。HSC 位于窦周间隙(Disse 间隙)内,形态不规则,生理条件下维持非增殖的静息状态,胞质内富含脂滴,是维生素 A 的主要储存场所。当肝损伤发生后,HSC被激活,细胞外基质 ECM 合成提高,并伴随增殖增加,细胞迁移和黏附增强,收缩性、炎症和趋化性等特征的改变,是形成肝脏纤维化的主要细胞类型,约占肝脏细胞总数的 5%。
1.1 肝脏窦状内皮细胞在正常的脂肪代谢过程中,LSEC 窗孔有效地将脂蛋白、乳糜微粒残余物和其他大分子从血窦转移到 Disse 间隙,并被肝细胞吸收。LSEC 窗孔形成一种选择性的脂质屏障,较大的脂蛋白不会穿过 LSEC 窗孔而留在窦腔。当 LSEC 窗孔受损时,血管内皮生长因子(VEGF)信号通路受阻,脂质的吸收也会受损。此外,LSEC 还通过高内吞能力调节脂质转移,具有快速吸收氧化或乙酰化低密度脂蛋白的能力。LSEC 还能调节肝内血管阻力和门静脉压力。在病理条件下,LSEC 发生毛细血管化及功能障碍,从而激活 Kupffer 细胞和 HSC,对于脂肪变性、炎症和纤维化反应具有重要影响,促进NAFLD 进展。
1.1.1 毛细血管化 肝脂肪变性的过程中,LSEC 发生形态和功能变化,最显著的表型变化之一是窗孔的丢失,也被称为毛细血管化,这种现象与 LSEC管腔表面基底膜的成形有关。LSEC 毛细血管化发生在 NAFLD 早期,并促进脂肪变性。过多的脂质或氧化型低密度脂蛋白(ox-LDL)暴露会诱发去窗孔化现象。LSEC 毛细血管化与肠道微生物群的数量和内毒素也有关,这也证实了肠道微生物群及内毒素与 NAFLD 的发病机制有关。质膜小泡相关蛋白(PLVAP)是形成内皮窗孔所需的内皮特异性完整膜糖蛋白,PLVAP 缺失小鼠模型表现出 LSEC窗孔数量的显著减少,并产生脂肪变性。LSEC 毛细血管化引发脂肪变性的一个重要原因可能是,LSEC 通透性降低损伤了由肝细胞向肝窦腔运输极低密度脂蛋白(VLDL)的通道,从而导致胆固醇和三酰甘油(TG)在肝内滞留,虽然这些脂蛋白可以通过淋巴系统逃离肝脏。而另一种解释是由于LSEC 毛细血管化导致血液中乳糜微粒无法运输到肝细胞进行 VLDL 的合成,因此作为一种代偿机制,增强了肝细胞的 DNL 从而引发了脂肪变性 。也有研究者补充,在 LSEC 毛细血管化后乳糜微粒和膳食来源的胆固醇不再穿过窗孔,抑制了肝细胞胆固醇合成的限速酶羟甲基戊二酸辅酶 A(HMG-CoA),从而激活了肝细胞内源性胆固醇的合成。因此抑制肝脏内皮细胞毛细血管化可能会是一个抑制脂肪肝形成的重要手段。
1.1.2 内皮功能障碍 在生理条件下,LSEC 释放 NO一方面起到调节肝内血管张力的作用,另一方面调节肝脏脂质代谢。内皮型一氧化氮合成酶(eNOS,也称 NOS3)/NO 抑制 DNL、通过抑制线粒体中柠檬酸盐的合成从而增强乙酰辅酶 A 羧化酶(ACC)和甘油-3-磷酸酰基转移酶(GPAT)的活性,进一步促进脂肪酸 β 氧化并抑制肝脏 DNL,发挥控制肝脏脂质含量的作用。LSEC 功能障碍通常表现为由于 eNOS 抑制而导致的 NO 生物利用度的减少或者丧失。各种原因导致的内皮功能障碍会降低或者抑制以上通过 eNOS/NO 控制肝脏脂肪含量的能力,从而促进脂肪肝形成。同样,脂质的过度积累和 IR也导致 eNOS 活性的下调、但相反诱导型一氧化氮合酶(iNOS)和还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶 1(NOX1)上调并产生过氧亚硝基化合物,这样降低了 NO 的生物利用度,增加氧化应激,导致内皮功能障碍,形成恶性循环。
脂肪肝形成时肝内血管阻力和门静脉压力有增加,增加的肝内血管阻力机械部分原因是充满脂肪的肝细胞压迫肝窦腔,而动态部分是由于肝内皮功能障碍引起,主要机制还是 eNOS/NO 的抑制。目前Ⅱ期临床的 NASH 新药 emricasan 部分治疗机制就是针对性改善 eNOS/NO。
1.1.3 血管生成作用 肝窦内皮细胞的激活是血管生成所必需的途径,以响应在肝脏修复过程中对营养和氧气的需求增加。肝脏新生血管生成也是 NAFLD进展的关键因素之一,其中 VEGF 是促血管生成的主要调节因子。临床研究发现早期脂肪变性的患者血清中 VEGF 水平高于健康人,db/db 小鼠蛋氨酸胆碱缺乏(MCD)饮食 3 d 后在肝脏中检测到VEGF 和 CD105 的表达也增加,而在 C57BL6/J 小鼠 MCD 饮食 1 周后也检测到 VEGF 和 CD105 表达增加。然而 NASH 患者的肝脏中发现了新血管的生成,但单纯脂肪变性患者或健康人中则未发现。这些现象证明了血管生成相关因子的上调一般发生在 NAFLD 早期阶段,而血管生成则出现在晚期。
随着 NASH 发展,慢性炎症促进血管生成。临床患者的血清中 VEGF 和可溶性血管内皮生长因子受体 1(sVEGFR1)水平动态升高 ,在 NASH 动物模型中发现肝血管系统损伤。LSEC 在 NASH 血管生成机制中的作用主要有 3 个方面:首先,慢性炎症维持组织缺氧状态并激活血管生成调控基因低氧诱导因子-1α(HIF-1α)转录,促炎介质通过诱导 HIF-1α 的转录活性以及 VEGF 生成,直接发挥血管生成作用;其次,发生脂肪变性的肝细胞会释放具有促血管生成的微泡;最后,血管生成素-1和-2(angiopoietin-1/2,Ang-1/2)在生理条件下有助于维持血管的稳定和静息状态,但在炎症发生时,LSEC 的 Ang-2 表达上调并促进病理性血管生成。证据表明抑制血管生成可以作为改善 NASH 和炎症的一种治疗策略。Coulon 等通过抗 VEGFR2 抗体改善了 NASH 小鼠模型的肝脏血管系统,降低炎症相关基因的表达。还有报道发现通过 Ang-2 抑制肽L1-10 阻断 Ang-2 与内皮酪氨酸激酶受体 2(Tie2)的相互作用, 下调 LSEC 中血管细胞黏附分子(VCAM-1)、细胞间黏附分子 1(ICAM-1)和单核细胞趋化蛋白 1(MCP-1)的表达,同样起到改善肝损伤和缓解炎症的作用。
1.1.4 氧化应激反应 除了肝细胞外,LSEC 也发生脂毒性反应并产生活性氧类(ROS)。小鼠的LSEC 暴露于棕榈酸会上调 NOX1 表达,而 oxLDL 也可以激活 LSEC 并与凝集素样氧化低密度脂蛋白受体 1(LOX1)结合,增加 ROS 的生成。LSEC 的氧化应激促进 NASH 的 发 展。NOX1 在NAFLD 的 LSEC 中高表达,而高脂饮食(HFD)诱导的 NOX1 基因缺陷小鼠血清谷丙转氨酶(ALT)水平与肝 Caspase3 表达水平较低,显示肝脏损伤程度减弱。因此,LSEC 的 ROS 在一定程度上进一步促进肝细胞损伤。
1.1.5 肝窦状内皮细胞在非酒精性脂肪性肝炎早期抗炎作用和晚期的促炎作用 在生理条件下,LSEC 构成一个屏障,调控循环的白细胞发挥抗炎作用。在NAFLD 进展的早期阶段,LSEC 也同样具有抗炎功能。LSEC 产生的一氧化氮可以抑制 Kupffer 细胞活化,人和小鼠 LSEC 体外短期暴露于 FFA 均表现出下调丝裂原活化蛋白激酶(MAPK)和巨噬细胞促炎性趋化因子的表达。
由于肝脏 NO 含量降低发生在 NF-κB 激活和肿瘤坏死因子 α(TNF-α)、 白 介 素 6(IL-6)、ICAM-1 的表达上调之前,因此 LSEC 的功能障碍早于 Kupffer 细胞活化的发生。功能失调的LSEC 不能维持 Kupffer 细胞的静止状态。失调的LSEC 表面过度表达 ICAM-1、VCAM-1、血管黏附蛋白 1(VAP-1),并随之产生了一系列促炎症因子如 TNF-α、IL-6、IL-1、MCP1,激活邻近的 Kupffer 细胞,促进了白细胞的募集、黏附和跨内皮迁移。脂肪组织产生的 ox-LDL、FFA 激活LSEC 内 NF-κB 和 Toll 样受体 4(TLR-4),连同部分脂肪因子共同增强 LSEC 的促炎作用。此外,NASH 肝细胞和炎症细胞释放的炎症介质也可以激活 LSEC。
综上,LSEC 炎症作用具有双面性,早期抗炎晚期促炎。因此针对 LSEC 靶向抗炎有可能会成为治疗 NASH 的一个重要选择。
1.1.6 肝窦状内皮细胞与肝纤维化 肝纤维化主要是由肝细胞损伤和炎症引发、HSC 活化造成细胞外基质过度沉积而导致的病理过程。LSEC 是 NASH 肝脏炎症的主要效应器,活化的 LSEC 与炎症细胞和损伤的肝细胞相互作用,促进 HSC 转移、分化成为具有收缩性和纤维化功能的肌成纤维细胞。
LSEC 毛细血管化也可促进肝纤维化。生理条件下 LSEC 可以维持 HSC 的静息状态,而纤维化过程中毛细血管化的 LSEC 与激活的 HSC 之间产生恶性循环。NASH 中气球样变的肝细胞和 LSEC 都释放 Hedgehog 配体,通过自分泌和旁分泌作用激活自体 LSEC 及静息的 HSC,而激活的 HSC 也可以分泌Hedgehog 分子,进一步促进 LSEC 毛细血管化,使HSC 过度激活并加速纤维化过程。LSEC 功能障碍与肝纤维化也有关,上调 LSEC 内 eNOS 的表达可以改善肝纤维化,反之抑制 eNOS 则阻碍 LSEC的功能并激活 HSC。通过激活可溶性鸟苷酸环化酶(sGC)、提高 LSEC 内 NO 水平并恢复 LSEC 窗口化,可以诱导 HSC 激活状态的逆转。
内皮细胞与器官纤维化相关联的一个重要过程是内皮-间充质转化(EndoMT)。健康的 LSEC 仅产生少量的胶原和纤维黏连蛋白,毛细血管化的LSEC 分泌转化生长因子 β1(TGF-β1)等纤维化因子以及纤维黏连蛋白、层黏连蛋白等细胞外基质蛋白,代表内皮细胞向间质的转变,同时刺激邻近HSC 的活化。然而,EndoMT 在 NASH 肝纤维化机制中是否是一个重要因素尚不清楚。
肝脏新生血管已被证实与 NASH 纤维化有关。NASH 肝纤维化的肝血管生成激活因子主要包括组织缺氧、瘦素作用、肝细胞衍生微泡和 Ang-2 等。NASH 患者血清中瘦素浓度升高,这种脂肪细胞因子通过上调 LSEC TGF-β 的表达,促进血管生成和纤维化。在 NASH 大鼠模型中,瘦素缺乏时未观察到血管生成和纤维化,HFD 小鼠 PHD2 基因敲除会导致 LSEC 中 Ang-2 和 TGF-β1 的过表达,进而促进肝纤维化 。Tie1 是血管内皮细胞的一种免疫球蛋白样 EGF 同源性的孤儿受体,具有调节血管生成的作用,白细胞衍生的趋化因子 2(LECT2)近期被鉴定为 Tie1 的功能配体。文献报道,LECT2能够中断 Tie1/Tie2 的异二聚化但促进 Tie2/Tie2 的同源二聚化,从而激活过氧化物酶体增殖剂激活受体(PPAR),抑制内皮细胞的迁移最终阻止汇管区血管形成。LECT2/Tie1 有可能成为抗肝纤维化的潜在靶点。此外,肝细胞和 LSEC 也通过 VEGF-A/VEGFR2 途径相互作用,促进纤维化阶段的血管生成 。
总之,LSEC 在单纯脂肪变性阶段开始就发生毛细血管化和内皮功能障碍,失调的 LSEC 无法维持 Kupffer 细胞和 HSC 的静息状态,进而促进了肝新生血管的生成、炎症反应以及纤维化的发展。因此改善 LSEC 的病理状态对于 NASH 及其并发症的预防治疗不失为极有潜力的专注方向。
NAFLD 发病过程中,受损的肝细胞释放的促炎因子增加,激活肝脏 Kupffer 细胞,进一步促进肝脏炎症反应和肝脏损伤等。Kupffer 细胞的激活以及紊乱的 M1/M2 表型极化比例在 NASH 的发生发展中发挥关键作用。
1.2.1 肝脏脂代谢紊乱与 Kupffer 细胞的激活 NASH患者体内的外周血和肝细胞中游离脂肪酸和脂质不断积累,可由脂毒素和脂多糖(LPS)刺激引发先天性免疫反应,而在 NAFLD 的炎症早期阶段,最重要的免疫细胞群是 Kupffer 细胞。在高脂高胆固醇诱导的 NASH 动物模型中发现 Kupffer 细胞体积增大、聚集以及促炎细胞因子的表达上调。脂质积累以及脂质诱发的肝细胞损伤的相关信号是导致Kupffer 细胞活化的主要因素 。
棕榈酸与 TLR2、TLR9 配体直接作用激活Kupffer 细胞,也可以间接通过 TLR4/MD2 复合物的内化激活 Kupffer 细胞 NOX2,释放 ROS。脂质代谢产物如二酰甘油、神经酰胺、胆固醇、氧化脂蛋白,以及过氧化产物如 4-羟基 -2-壬烯醛和丙二醛,也可以激活 Kupffer 细胞,吞噬凋亡的肝细胞。
低密度脂蛋白胆固醇在肝细胞脂膜上形成胆固醇晶体,在人和小鼠的 NASH 模型的肝脏中均发现胆固醇晶体。Kupffer 细胞利用清道夫受体过量摄取富含胆固醇的脂蛋白,导致胞内脂质累积而产生脂毒性,激活 NLRP3 炎症小体的组装,增强淋巴细胞的募集、促进炎症反应。同时,Kupffer 细胞中脂质的积累导致线粒体功能障碍和内质网应激,进一步促进 NF-κB、JNK 和 CEBP 通路的激活,加重了 IR和细胞凋亡。
脂肪组织产生的瘦素通过激活 Kupffer 细胞iNOS 和 NADPH 氧 化 酶, 引 发 氧 化 应 激, 上 调TGF-β1 和结缔组织生长因子(CTGF)的表达。瘦素还可以通过增加 CD14 的表达以增强 Kupffer 细胞对 LPS 的敏感性,导致肝脏炎症加剧。与瘦素作用相反,胆汁酸通过激活法尼醇 X 受体(FXR)和 G蛋白偶联受体 TGR5,抑制炎症小体、促进抗炎细胞因子的分泌,这一抗炎作用也使得 FXR 成为目前最具价值的治疗 NAFLD 的靶点之一。
1.2.2 Kupffer 细胞的表型与非酒精性脂肪性肝炎 肝脏的炎症和纤维化依赖于促炎性 M1 和抗炎性 M2这 2 种 Kupffer 细胞亚群之间的平衡调节。失衡的M1/M2 表型 Kupffer 细胞已成为 NASH 发展的核心机制。M1 型 Kupffer 细胞具有吞噬活性,产生促炎细胞因子和 ROS,加速了脂肪变性、炎性免疫细胞的募集以及纤维化的形成。M1 表型是由 LPS、干扰素-γ(IFN-γ)和 TNF 等促炎信号诱导,产生促炎细胞因子(如 TNF-α、IL-6)和趋化因子及配体(如CCL2、CXCL16、CXCL1/2/8)。M2 表型具有吞噬活性、组织重塑、免疫抑制以及促纤维化作用,由 IL-4、IL-10、IL-13、IL-33、TGF-α、TGF-β、PPARγ 或 δ 激活。M2 表型 Kupffer 细胞通过 IL-4、IL-13、IL-10 或糖皮质激素诱导炎症反应,并可以刺激新血管和疤痕的形成。M1/M2 表型的比值在NAFLD 进展过程中逐渐升高,因此抗炎表型的逆转可以作为增强抗炎信号、改善 NAFLD 进展的一个研究方向。近期有研究发现利拉鲁肽可以通过cAMP-PKA-STAT3 信号通路调节 HFD 小鼠模型和体外模型中 Kupffer 细胞 M2 极化,降低炎性因子TNF-α 和 IL-12 的表达,达到改善炎症的效果。利拉鲁肽这种逆转 Kupffer 细胞表型的治疗策略能否阻断 NAFLD 的炎症和纤维化值得进一步研究。
1.2.3 Kupffer 细胞与非酒精性脂肪性肝炎炎症和纤维化 在人类和小鼠 NASH 模型中,肠道菌群失调和肝细胞凋亡分别通过损伤相关的分子模式(DAMP)和病原体相关的分子模式(PAMP)激活 Kupffer 细胞 TLR4、TLR9、CD14,发挥促炎作用。肽聚糖与 Kupffer 细胞 TLR2 结合激活 NLRP3炎症小体,LPS 与 TLR4 结合、细菌 DNA 与 TLR9结合激活 Kupffer 细胞 NF-κB,促进生成 TNF-α 和ROS,同时也增强了 IR。
肝损伤产生的 ROS 进入循环中可直接诱导Kupffer 细胞产生 TNF,增加 Kupffer 细胞对 LPS 的敏感性。ROS 损伤的肝细胞释放含有线粒体 DNA的外泌体,线粒体DNA通过TLR9激活Kupffer细胞,直接结合并激活 NLRP3 炎症小体,促进 IL-1β 的分泌,引发 NAFLD 炎症反应。也有研究认为,受损肝细胞线粒体 DNA 也可以通过刺激 Kupffer 细胞的干扰素基因刺激因子(sSTING)激活 NF-κB 依赖的炎症反应。线粒体 DNA 可能是氧化应激与炎症反应之间的关联因素,因此控制受损肝细胞线粒体 DNA 释放的相关介质可能是治疗 NAFLD 的潜在靶点。
Kupffer 细胞分泌脂酶、脂质结合蛋白以及炎性细胞因子如 IL-1β、TNF-α 和 CCL2,这些细胞因子通过激活促炎信号以及抑制胰岛素受体信号,从而下调肝脏对胰岛素的敏感性,提高脂质的摄取,表现出促炎表型。M1 促炎表型 Kupffer 细胞通过抑制PPARα,从而促进 TG 的合成,同时抑制脂肪酸氧化,进一步加剧脂质积累、促进脂肪变性和炎症。
Kupffer 细胞吞噬循环中的补体蛋白也可以产生细胞因子和趋化因子,这些趋化因子与激活的LSEC 协同刺激单核细胞、NKT 细胞和中性粒细胞向肝脏募集,激活先天免疫网络,从而引发持续的炎症反应。
NAFLD 受损的肝细胞通过释放 DAMP 激活Kupffer 细胞和 HSC,从而导致 NASH 和肝纤维化。Kupffer 细胞是肝脏细胞中 NLRP3 炎症小体和 IL-1β的主要来源,IL-1β 基因敲除或 NLRP3 抑制均可以改善 NASH 小鼠模型的肝脏炎症和纤维化 。近期有研究人员在 NASH 门静脉中游离胆固醇和 oxLDL 积聚的区域检测到 Kupffer 细胞的积聚与较高水平的 IL-1β,这种现象引起的门静脉粥样硬化是NAFLD 独特的特征,该研究揭示了 NAFLD 中胆固醇的积聚与 Kupffer 细胞参与的门静脉炎症以及纤维化的形成密切相关。
激活的 Kupffer 细胞分泌 TGF-β、Galectin-3、血小板衍生生长因子(PDGF)、TNF-α 以及 IL-1β等细胞因子,可以激活 HSC 并有助于 HSC 的增殖,促进肝纤维化的形成。有研究发现 NASH 患者肝脏中激活素 A 以及激活素 A/激活素结合蛋白的比值仅在肝硬化阶段显著升高,这种 TGF-β 家族的细胞因子可以通过诱导 Kupffer 细胞分泌 TNF-α和 TGF-β1,间接激活 HSC 并促进Ⅰ型胶原的分泌,因此激活素 A 可能成为 NASH 纤维化的潜在治疗靶点。在 NAFLD 大鼠模型的 Kupffer 细胞和NASH 患者肝组织中 Hippo 通路关键效应分子 YAP(Yes-associated protein)表达显著增加,NASH 患者 YAP 水平与纤维化相关基因的表达呈正相关,提示 Kupffer 细胞 YAP 高表达与纤维化有一定相关性。
以上结果表明 Kupffer 细胞在 NAFLD 不同阶段的炎症反应和纤维化的形成有密切的关系,靶向Kupffer 细胞特定的信号通路有助于抑制 NASH 发生和进展。
在肝脏中,除 Kupffer 细胞外,先天免疫细胞如中性粒细胞、树突状细胞(DC)、淋巴细胞以及LSEC 等共同组成相互协调的先天免疫细胞网络,这些细胞能够识别病原体、PAMP 和 DAMP 以及过量的代谢产物水平,引发炎症反应和代谢功能障碍,推动 NAFLD 的进展。
1.3.1 中性粒细胞 中性粒细胞被认为是先天免疫反应的主要效应器,在肝巨噬细胞活化和 NASH 进展中发挥了重要作用。肝脏代谢损伤和细菌过度生长引起中性粒细胞的深度活化和募集,而中性粒细胞可以激活 Kupffer 细胞和内皮细胞,导致细胞黏附分子的上调,并引发其他下游细胞的募集。在啮齿类动物模型中诱导中性粒细胞耗竭,可减轻 HFD 诱发的肝脂质积聚和炎症,从而阻止 NASH 的进展 [37]。中性粒细胞过度活化,释放髓过氧化物酶(MPO)、中性粒细胞弹性蛋白酶(NE)、蛋白酶 3、组织蛋白酶和基质金属蛋白酶 9(MMP-9),这些蛋白酶可以增加氧化应激,进一步促进肝损伤。MPO 诱导线粒体通透性转换孔形成,可直接导致肝细胞死亡。NE 可以激活 TLR2 和 TLR4 受体,水解溶酶体以及ECM 中的蛋白质。肝巨噬细胞 TLR4 信号的激活增加了肝窦中性粒细胞黏附,中性粒细胞也通过抗原提呈的方式促进巨噬细胞的进一步募集。此外,中性粒细胞也会通过 MPO、MMP-9 等蛋白的释放,激活并促进 HSC 的增殖来加速纤维化。
1.3.2 树突状细胞 DC 能感知局部环境特征,识别病原体和危险信号,并在先天性和适应性免疫反应之间起桥梁作用。根据肝脏微环境以及胞内脂质含量的变化,肝树突细胞的表型可以由耐受性转变为免疫原性 [24]。肝树突状细胞(HDC)参与淋巴细胞抗原递呈和肝免疫反应的调节。有研究发现 HDC在疾病过程中起促炎作用,CD11c+ DC 或 CD103+DC 的耗竭可以降低促炎细胞因子和趋化因子的表达,从而降低肝脏脂肪含量 [24],但在其他研究中发现 CD11c+DC 在 MCD 诱导的纤维炎症中起保护作用,并在胆总管结扎和四氯化碳诱导的肝纤维化模型有中性效应。这些相互矛盾的研究结果可能是由于 NASH 动物模型的差异造成的,饮食的影响使DC 表型发生转换,但目前 DC 在 NASH 中的作用仍未明确。
1.3.3 肝常驻淋巴细胞 先天性淋巴细胞(ILC)、自然杀伤细胞(NK)、恒定自然杀伤 T细胞(iNKT)、黏膜相关恒定 T 细胞(MAIT)是肝脏先天免疫系统中重要的淋巴细胞群,但由于细胞数量稀少、缺乏明确的表面标志物以及异质性,对其在 NASH 中作用的研究面临巨大挑战。ILC1 是肝脏中一个主要的先天性细胞群,受应激细胞表达的 IL-12/IL-18 细胞因子以及 CCL5、CXCL10 等趋化因子刺激产生CCL2、CCL3、CCL4,促进巨噬细胞和 NK 细胞的迁移。ILC1 的耗竭与巨噬细胞浸润的减少、M1 型极化以及 IR 有关 [39],其与巨噬细胞的交互作用是炎症调节的关键因素。活化的 ILC2 通过分泌 IL-13、IL-4 激活 HSC。NK 细胞通过产生 IFN-γ 以及死亡受体 TRAIL、FASL 刺激 HSC 的凋亡、拮抗 HSC分化的肌成纤维细胞或与其他免疫细胞的协同作用,发挥抑制纤维化的作用。在四氯化碳诱导或胆管结扎诱导的肝损伤过程中发现 iNKT 细胞和 MAIT细胞等先天性 T 淋巴细胞具有促进炎症和纤维化的功能,但这些先天性 T 淋巴细胞在 NASH 发病中的作用机制尚不明确。
1.3.4 单核细胞来源的巨噬细胞 组织学上,NASH的炎症表现为巨噬细胞、单核细胞、中性粒细胞和淋巴细胞等炎性细胞的浸润。在小鼠模型中发现 Ly6C(Gr-1)和 CCR2 在巨噬细胞和 DC 的前体单核细胞中的表达水平较高,并在肝损伤后迅速渗透到肝脏组织中。这些单核细胞来源的巨噬细胞(MDM)最初起到促炎和抗炎作用,同时也可以调控组织修复和损伤修复。MDM 的浸润是肝脏损伤的一个重要特征,不同亚群的浸润性 MDM 在肝纤维化中起相反的作用。在组织损伤或损伤的早期,CCL2 表达的增加促进 CCR2hi/Ly6Chi 单核细胞在肝脏组织中的募集,招募 Ly6Chi 骨髓源性单核细胞已被证明是促进 NAFLD 和 NASH 的关键步骤。四氯化碳诱导的小鼠肝纤维化模型中,浸润的单核细胞主要由 Ly6Chi 单核细胞分化为 Ly6Chi 巨噬细胞,NAFLD 过程中的组织微环境因素也会促进 Ly6Chi巨噬细胞的转化。浸润的 Ly6Chi 单核细胞分化后直接与 HSC 相互作用,HSC 可以产生促纤维化细胞因子 TGF-β,因此 Ly6Chi 肝巨噬细胞具有促纤维化功能。然而,Ly6Clow 巨噬细胞产生 MMP 具有改善肝纤维化的功能,表明不同肝巨噬细胞同时具有促纤维化和抗纤维化功能 。
趋化因子受体 CXCR3 是一种 CXCL10 受体,可以介导骨髓源性单核细胞浸润和炎性细胞因子的分泌。巨噬细胞中的 CCL2 和 CCL5 激活 HSC 导致纤维化。这些被招募的单核细胞与 Kupffer 细胞协同促进炎症,促进趋化因子和细胞因子如 TNFα 和IL-1β 的表达和分泌,进一步促进骨髓源性单核细胞浸润,增强肝脏炎症反应。最近有研究利用单细胞水平的全基因组分析技术发现一类具有 Term2+、CD9+、Gpnmb+ 的特征性肝巨噬细胞亚群,命名为 NASH 相关巨噬细胞(NAM),这类肝巨噬细胞可能具有吞噬凋亡细胞、脂质碎片以及组织重塑的潜在作用,但其来源和具体位置尚不明确 。
1.4 适应性免疫细胞越来越多的研究证实淋巴细胞介导的适应性免疫在 NASH 中的重要作用。60% 的 NASH 患者的肝脏中 B 细胞和 T 细胞形成局灶性聚集,且其大小和患病率与小叶炎症和纤维化评分呈正相关。
1.4.1 CD4+T 辅助细胞 M1 巨噬细胞刺激 CD4+T 细胞分化为 T 辅助细胞 1(Th1),NASH 患者的肝脏Th1 细胞水平升高,IFN-γ 水平与肝淋巴细胞聚集数量、大小以及纤维化的严重程度呈正相关。Th1是一种促炎细胞,通过上调 IL-12、TNF-α 等细胞因子的表达促进肝脏炎症反应。NASH 晚期阶段的MCD 模型小鼠中肝脏 Th1 细胞水平升高,促进纤维化的发展。CD4+T 细胞也能分化为高度促炎的 Th17,表达维甲酸孤儿受体-γt 并产生 IL-17,产生少量的 IL21、IL-22、IFN-γ、TNF,其中 IL-17 与肝损伤的发病机制相关。Th17 的细胞水平随着 Th1 细胞水平的升高而增加,而 NAFLD 进展为 NASH,与 Th17 的显著积聚有关。Th17 刺激脂肪细胞、巨噬细胞和单核细胞分泌 IL-6、IL-1β 以维持炎症反应,还可以降低肝脏、肌肉和脂肪组织的胰岛素敏感性 。Th17 通过上调 IL-17 依赖性 CXCL10 的表达导致巨噬细胞的聚集,并通过激活 HSC 的 JNK 和 STAT3途径诱导胶原的产生,从而发挥促纤维化作用。IL-17 家族受体缺失导致 HFD 或 MCD 诱导动物模型脂肪肝减少 ,Th17 和 IL-17 是 IR 和脂肪性肝炎发生的必要因素。
Th22 是一种产生 IL-22 的 CD4+T 细 胞。与IL-17 的作用相反,IL-22 通过抑制 PI3K 进而抑制JNK1 和 JNK2,但仅在 IL-17 缺失的情况下,IL-22才能发挥明显作用。Th22 和 Th17 之间可能存在拮抗作用 [52]。在 NASH 进展过程中,Th17 产生的免疫反应也会受到 Th22 分化以及同样可以产生 IL17A 的 γδ T 细胞的影响 [53],Th17 和 Th22 相互作用可能影响 NASH 小叶炎症严重程度。因此 CD4+ T细胞亚型对 NASH 作用可能不同。
1.4.2 CD8+T 毒性细胞 CD8+T 细胞主要是对 IFN-α介导的信号作出应答,促进了 IR 和肝脏的葡萄糖代谢。HFD 动物模型肝脏中 CD8+T 细胞水平增加,并且 CD8+T 细胞的浸润早于巨噬细胞浸润。CD8+T细胞通过释放趋化因子招募巨噬细胞。利用 CD8 中和抗体阻断 CD8+T 细胞功能可以改善 IR、肝脏脂肪变性和肝脏炎症,CD8+T 细胞和 NKT 细胞缺陷的小鼠在 MCD-HFD 诱导下可避免脂肪变性和NASH 的发生 [54]。NASH 中的 CD8+T 细胞具有较高的 TNF-α、IL-6 表达水平,同时 TGF-β 的表达也明显增加,选择性耗竭 CD8+T 细胞也能显著降低 HSC的活化和巨噬细胞的积聚,有效改善脂肪变性和纤维化 。但 CD8+T 细胞在 NASH 中的具体作用仍有待进一步研究。
1.4.3 B 淋巴细胞 B 细胞可以产生促炎症介质并发挥抗原递呈作用,促进 T 细胞和巨噬细胞的激活,参与 NASH 中的炎症反应及肝纤维化的发生。B1细胞和 B2 细胞在 NAFLD 的发病机制中可能存在拮抗作用,B1 细胞产生以 ox-LDL 为靶点的 IgM 从而发挥抗炎作用,而产生 IgG 的 B2 细胞则发挥促炎作用。在 NASH 小鼠模型中,CD43-CD23+B2 细胞参与适应性免疫反应,同时肝脏中 B 细胞激活因子表达上调,且循环水平与脂肪变性和纤维化的严重程度相关。NASH 患者的 B 细胞活化与主要组织相容性复合物Ⅱ表达上调有关,且在肝脏的募集早于 CD4+ 和 CD8+T 细胞,抑制 B2 细胞可以降低肝脏 Th1 的活化以及 IFN-γ 的表达 [46]。B 细胞 IL-8、IL-6、TNF-α 等促炎症介质表达上调,IL-10 表达下调,刺激 HSC 和巨噬细胞,发挥促炎、促纤维化作用,而活化的 HSC 则通过分泌维甲酸维持肝脏 B细胞的存活及成熟。B 细胞抗原递呈作用也会促进 IR,B2 细胞缺乏或功能阻断的小鼠模型中肝脏脂肪炎症和 IR 得到改善 。因此调节适应性免疫可以改善肝脏脂质代谢和脂肪变性。
1.4.4 调节性 T 细胞 调节性 T 细胞(Treg)是一种表达叉头样转录因子(FOXP3)的 T 细胞亚群。在肝脏内 DC 通过程序性细胞死亡配体 1(PD-L1)的表达以及 IL-10 的分泌,引导 CD4+T 细胞向 Treg 分化。Treg直接抑制CD4+和CD8+T细胞的增殖和功能,在调节肝脏免疫耐受中起关键作用。Treg FOXP3 与Th17 维甲酸孤儿受体-γt 结合,抑制 Th17 分化,影响 Th1/Treg 这 2 个亚群之间的平衡 [47]。NAFLD 患者的 Treg 细胞水平低于健康人的 Treg 细胞水平 。Treg 在病理环境比如 NASH 更易发生凋亡,这可能也与局部 ROS、DC 的免疫抑制功能或 IL-33 介导的对 Treg 细胞分化信号的干扰有关。Treg 通过分泌 IL-10 抑制纤维化的发展。因此 Treg 可能具有抑制 NASH 发生的作用。
2肝脏不同细胞交互作用贯穿穿非酒精性脂肪性 肝炎疾病进展不同阶段NAFLD 作为复杂的代谢相关疾病,其发病机制涉及多种不同种类和功能的细胞群,这也是 NASH治疗新靶点开发所面临的巨大挑战。在 NAFLD 初始阶段,代谢紊乱和高热量饮食等不同原因引起肝细胞中游离脂肪酸和脂质代谢产物的异常积累,导致肝脏脂肪变性。肝细胞损伤释放细胞因子/趋化因子、DAMP 外泌体等,激活肝脏不同细胞类型,包括 Kupffer、LSEC 和 HSC,促进炎症和纤维化形成(NASH 阶段)。与此同时,其他天然免疫和获得性免疫细胞(如中性粒细胞、DC、NKT 等)也不同程度参与激活过程并分泌炎性因子等。需要强调的是,Kupffer 细胞通过分泌炎性细胞因子和趋化因子,招募免疫细胞、激活 HSC,在炎症和纤维化发生机制中可能发挥中心角色。此外,肠道微生物群起源的 LPS 和脂肪组织分泌的脂肪细胞因子也作用于不同的肝脏细胞,进一步加剧炎症和纤维化,最终导致 NASH 的发生和发展。因此,除了单一细胞的表型和功能的改变,细胞间的交互作用也是 NAFLD/NASH 发病机制的一个重要因素。
2.1 先天性免疫与适应性免疫相互作用先天性免疫与适应性免疫在 NASH 发病机制上存在交互作用。由 Th1、Th17 和 CD8+T 细胞产生的细胞因子可以刺激 M1 巨噬细胞的激活,而 M1巨噬细胞也可以通过释放 IL-12、IL-23、CXCL9、CXCL10、CXCL11 等介质促进淋巴细胞的功能。淋巴细胞刺激巨噬细胞分泌产生的 IL-15 和 IL-18 也可能促进 NK 细胞的激活,这也被认为是脂肪性肝炎和纤维化的分子机制之一。
NKT 细胞是一种 T 细胞受体和 NK 细胞表面受体 CD161 或 CD56 共表达的先天性免疫 T 细胞亚群。NKT 细胞识别 CD1d 抗原递呈细胞递呈的脂质抗原,并分泌 IL-4、IL-10、IFN-γ 和 TNF 等多种细胞因子,促进 Th1、Th2 和 CD4+CD25+Treg 活性。在NASH 晚期动物模型中抑制 NKT 细胞的功能可以有效改善肝实质损伤、炎症和纤维化程度,进一步研究发现 NKT 细胞缺乏减少了 CD8+T 细胞的浸润,这表明细胞毒性 T 细胞和 NKT 细胞之间存在促进脂肪性肝炎的相互作用。氧化应激受损的肝细胞中 IL-15 表达上调,促进 NKT 细胞的激活。IL-15或 IL-15Rα 缺失会导致 CD4+ 和 CD8+T 细胞、NKT细胞的耗竭,脂肪变性和小叶炎症的严重程度减弱。因此 IL-15 可能是连接 NASH 先天性免疫细胞与适应性免疫细胞网络的重要信号分子。
OX40 是 TNF 家族一种免疫共刺激分子,主要表达在适应性免疫 T 细胞上,而其配体 OX40L 在DC、MDM 等先天性免疫细胞上表达。OX40 可以刺激 Th1 和 Th17 的增殖、分化,同时上调 MDMOX40L 的表达,促进了 NASH 中单核细胞的迁移活化以及 M1 型巨噬细胞的极化募集。OX40/OX40L 信号同时激活先天性免疫和适应性免疫,是NASH 发病进程的关键因子。
2.2 肝星状细胞和其他细胞的相互调节肝细胞损伤会释放 ROS 等一系列介质,引发炎症反应和纤维化。肝细胞死亡释放大量 DAMP,直接或间接促进 HSC 的激活和纤维化的形成。肝细胞释放的 IL-33 通过激活 ILC 介导 HSC 活化和肝纤维化。HSC 吞噬肝细胞凋亡小体也可以促进其自身活化。肝细胞来源的外泌体激活 HSC,通过促进 γδT细胞产生纤维化因子而增强肝纤维化。LSEC 在病理条件下发生毛细血管化,无法维持 HSC 的静息状态,因此毛细血管化的逆转是抑制 HSC 激活状态的一个药物靶点开发方向。失调的 LSEC 通过 FGFR1和 CXCR4 旁分泌刺激 HSC 的活化。此外,肝细胞和 LSEC 也通过 VEGF-A/VEGFR2 途径相互作用,促进纤维化阶段的血管生成。Kupffer 细胞通过产生ROS、iNOS 以及 PDGF、TGF-β1、MCP1 等细胞因子刺激 HSC 的活化。肝损伤诱导肝祖细胞或胆管细胞的增殖,这种胆管反应通过增强 Hedgehog 信号,激活 HSC,促进肝纤维化。
MDM 通过旁分泌调节 HSC 活化,同时具有促纤维化和抗纤维化这 2 种作用。Ly6Chi 巨噬细胞分泌促纤维化介质,如 TGF-β、PDGF、TNF、IL1β、CCL2、CCL3、CCL5、CCL7 和 CCL8。TNF和 IL-1β 等促炎性细胞因子通过 NF-κB 的激活促进HSC 活化。巨噬细胞释放的凝集素 Galectin-3 可以促进 HSC 激活,现已被用于 NASH 药物开发。而另一种亚型 Ly6Clow 细胞分泌化因子受体 CX3CR1,促进活化的 HSC 的凋亡, 同时分泌MMP-12 和MMP-13,促进 ECM 的降解。
CD4+T 细胞分泌的 IL-17A 与 HSC 表面的IL-17 受体结合,通过激活 STAT3 信号通路诱导Ⅰ型胶原的表达。NK 细胞通常具有抗纤维化的特性,产生 IFN-γ,导致 HSC 的凋亡及细胞周期阻滞,也可以利用 FASL/Fas 途径诱导 HSC 的凋亡。此外,NK 细胞可以促进衰老的激活态 HSC 的清除,有助于肝纤维化的改善。NKT 细胞也可以产生IFN-γ,直接杀伤激活的 HSC,但同时 NKT 细胞也会产生 IL-4、IL-13、骨桥蛋白以及 Hh 配体,通过CXCR6/CXCL16 途径促进 HSC 的激活和肝纤维化的进展。B 细胞通过促炎症介质刺激 HSC,发挥促纤维化作用。
活化的 HSC 可以产生促炎性细胞因子、趋化因子以及炎症小体,作为抗原提呈细胞介导自噬,控制凋亡小体吞噬坏死或凋亡的肝细胞,促进 ROS的形成和 NOX 的激活,与巨噬细胞、中性粒细胞、NK 细胞等多种免疫细胞相互作用,调节免疫细胞的趋化性,或直接调节免疫细胞的活化、分化、增殖、存活和凋亡。NASH 早期阶段,HSC 分泌 CCL5,直接作用于肝细胞 CCR5,诱导肝细胞的脂肪变性以及促炎因子的上调。HSC 激活后分泌大量胶原,造成 Disse 间隙中胶原过度积累,导致 LSEC 窗口丢失。此外,活化的 HSC 产生 Hh 信号分子,增强 LSEC 毛细血管化。肝损伤过程中 HSC 通过缺氧诱导因子-1α 激活 Kupffer 细胞,上调 Kupffer 细胞中 CXCL1、CXCL2 等炎性细胞因子的表达,下调 IL-10 的表达,促进炎症反应。中性粒细胞具有自发性凋亡特征,半衰期仅有 6 ~ 8 h,中性粒细胞可以通过 ROS 和凋亡小体激活 HSC。随后,活化的 HSC 产生粒细胞-巨噬细胞集落刺激因子(GMCSF)和 IL-15,提高中性粒细胞的存活率,从而加剧肝脏炎症 。激活的 HSC 释放 CCL2、CCL4、CX3CL1 等促炎趋化因子,招募 Ly6C(Gr1) 单核细胞,促进巨噬细胞分化。此外,激活的 HSC 促进ICAM1 和 VCAM-1 依赖性淋巴细胞的黏附和迁移,通过维甲酸-MyD88 依赖性途径增强 B 细胞活性,促进 CD11c+ DC 和 Ly6Chi 单核细胞的浸润。
2.3 多细胞组成的理想肝脏体外模型:模拟体内肝脏微循环和生理2D 细胞培养或原代细胞 2D 培养已被广泛应用于肝病机制与早期药物筛选,但这些体外模型在实际应用中往往存在许多局限性。2D 细胞培养的细胞遗传信息相对恒定,不能充分显示个性化的肝脏生理和病理,而原代肝脏细胞的 2D 培养虽然可以保存遗传信息的异质性,但由于难以在体外长期培养以及缺乏合适的细胞微环境,会逐渐去分化、关键代谢酶的表达和活性丢失。此外,由于 NASH 复杂的发病机制涉及到多种肝脏细胞群,并且肝纤维化的关键驱动因素 HSC 活化过程存在复杂的细胞交互作用,单一种类细胞的体外模型已无法满足药物开发需求。因此迫切需要开发一种可模拟复杂的NASH 病理生理情况的体外模型。
3D 细胞培养技术采用单一细胞或多种细胞共培养,实现异质细胞、细胞与细胞外基质之间的相互作用,建立与体内相似的生理、生化和生物力学微环境,再现细胞增殖、分化、形态变化、细胞迁移、机械反应。3D 细胞培养模型可以采用水凝胶基质或固态支架提供三维结构,也可以通过不依赖支架的制备方法如悬滴法、旋转培养和磁力悬浮等三维培养方法。肝细胞与 HSC、Kupffer 细胞、LSEC 等非实质细胞的共培养已被证实通过提供旁分泌和机械支持来改善整体肝细胞的功能和代谢活动。由于炎症、纤维化等 NASH 主要临床终点不是完全由肝细胞驱动的,因此非实质细胞的共培养也有利于疾病相关终点的评估。有研究构建了 PNPLA3 I148M人肝细胞和永生化人 HSC 共培养模型,HSC 在基质重塑中起重要作用,促进了 3D 球体的致密,当暴露在 FFA 中时 3D 球体内细胞出现了脂肪积累和胶原沉积。研究人员基于 3D InSightTM 技术,通过原代人肝细胞、HSC、Kupffer 细胞、LSEC 共培养的 3D 人肝脏微组织系统,经棕榈酸刺激建立了一种具有严重纤维化的 NASH 模型,炎症和纤维化过程中主要标志物如 IL-8、胶原、α-平滑肌肌动蛋白(α-SMA)、血小板衍生生长因子受体(PDGFR)的表达和 TGF-β 信号的激活等均得到验证。人精密肝切片(HPCLS)模型是一种特殊的 3D 模型,具有保留天然肝脏微结构和异质细胞相互作用的优点,HPCLS 会表现出外表面进行性坏死和肝功能快速去分化。目前已开发更精密的切片技术以及复杂的灌注技术将 HPLCS 的生存周期从几个小时延长到几天,但持续给药时间和代谢基因的表达仍受限制。
类器官培养(organoids)利用特殊的 3D 培养技术将成体干细胞(ASC)、胚胎肝细胞(ESC)或诱导多能干细胞(iPSC)在体外培养,通过生长因子或特定条件诱导定向分化,形成具有一定形态、结构和功能的类似于器官的细胞团结构。人PSC 在无血清培养基中能成功诱导为成熟的肝细胞样细胞,这种来源的肝细胞样细胞可以与间充质干细胞、内皮细胞共培养形成肝脏组织类器官,并且检测到微血管的生成,基因表达与胚肝来源的基因表达具有高度相似性,iPSC 也能够诱导形成含有肝细胞和胆管细胞的肝胆结构。对于遗传缺陷引发的 NASH,干细胞诱导类器官模型的组织基因表达和代谢可以与患者的肝组织高度相似。此外,肝脏类器官模型与微流控芯片技术相结合开发的肝脏类器官芯片技术(liver-on-a-chip),通过生物传感器动态监测多项靶标,实现高通量筛选和分析。 类器官模型具有遗传稳定、再现表观遗传特征、可实现高通量药物筛选、精准医疗等优势,可能是未来最具有临床价值的遗传缺陷相关疾病的体外模型之一。iPSC 来源的肝细胞类器官模型是否能模拟NAFL到NASH、NASH到肝硬化或肝癌的进展过程,而是否可以借助个体化模型开发特异性生物标志物并预测个体化治疗方案,这些仍有待进一步研究。
3肝脏细胞与非酒精性脂肪性肝炎治疗药物靶点由于 NASH 的发病机制的复杂性,潜在靶点较 多,目前全球还没有治疗 NASH 的药物获批上市,大部分药物仍处于临床试验阶段,其作用机制及靶 向的肝脏细胞各不相同(见表 1)。
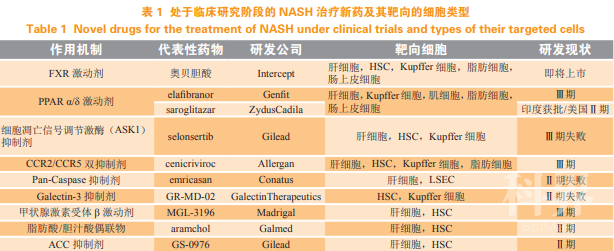
Intercept 公司的奥贝胆酸(OCA)Ⅲ期临床研究 获得成功,公司现已向美国 FDA 提交了 OCA 治疗 NASH 所致的纤维化的新药申请,该药有望成为首个上市的 NASH 药物。OCA 是一种 FXR 激动剂,直接 作用于肝细胞,激活 SREBP1c 介导的脂肪合成以及 PPARα 介导的游离脂肪酸 β 氧化;下调糖异生途径、 增加 IRS1 磷酸化以及 PI3K 偶联,提高胰岛素敏感 性,同时增加胆固醇向胆汁的输送,减少胆汁酸合成;FXR 的激活可以降低肝脂酶活性、载脂蛋白和高密度 脂蛋白胆固醇的合成以及 VLDL 的分泌,减少 NF-κB 的激活,减轻炎症反应。OCA 可以靶向 Kupffer 细胞等巨噬细胞,减少 1κBα 的磷酸化和 NF-κB 的激活,导致 TGF-β 分泌降低 [13],并且降低 Kupffer 细胞金 属蛋白酶组织抑制因子-1 的分泌,增加 ECM 降解。OCA 还可以靶向 HSC,抑制 HSC 的激活或增殖,降 低 CCL2 的分泌以及 TGF-βR 的表达,从而减少炎症 和纤维化。近期有研究证明 OCA 通过激活 HSC 胞浆 FXR 的核移位,增强 FXR 和 Smad3 之间的相互作用,抑制 Smad3 的磷酸化从而下调 α-SMA 的表达。此外,OCA 可以靶向脂肪细胞,上调 PPARγ 和脂联素的表达水平,降低 TNF 分泌,逆转脂肪组织的功能 紊乱;通过靶向肠上皮细胞,增强肠道屏蔽功能,减 少 LPS 移位,促进 FGF19 的分泌,促进胆汁酸合成 和脂肪氧化。
Genfit 公司的 PPARα/δ 激动剂 elafibranor 目前 处于Ⅲ期临床试验阶段,PPAR 靶点主要与糖脂代 谢相关。Elafibranor 直接作用于肝细胞、肌细胞和 脂肪细胞,通过上调涉及线粒体和过氧化物酶体的 脂肪酸 β 氧化、微粒体 ω 氧化、血浆脂肪酸膜转 运相关蛋白的表达,增强脂质氧化、游离脂肪酸摄 取、TG 脂解水平,刺激肝细胞 FGF21 的表达上调, 降低肝细胞补体 C3 的分泌以及 NF-κB 的激活,同 时减少 IL-6、IL-1、TNF、ICAM1 和 VCAM1 的表 达,从而降低炎症反应和内皮功能紊乱。通过靶 向 Kupffer 细胞等巨噬细胞,降低 NF-κB 激活以及 TGF-β1 分泌,促进 M1 向 M2 表型的极化。目前 ASK1 抑制剂代表药物有 selonsertib,但 其针对严重纤维化和肝硬化的Ⅲ期临床试验均宣告失败。ASK1 可以靶向多种细胞,在机制上应可以 通过抑制肝脏细胞凋亡以及炎症信号通路,改善炎 症和纤维化。ASK1 抑制剂可以抑制肝细胞凋亡, 由于严重纤维化 NASH 患者肝脏内同时也存在大量 的促炎性 M1 巨噬细胞和激活状态的 HSC,因此同 样的抑制作用可能也保护了极化的 M1 巨噬细胞和 激活状态 HSC,这 2 种截然相反的效果是否导致了 ASK1 抑制剂在Ⅲ期临床试验失败的原因仍有待进 一步研究,这也是其他抗凋亡靶点研究需要考虑的 问题。近期有研究发现 ASK1 的抑制也会阻断自噬从而促进肝脏脂肪积聚和肝纤维化,而 ASK1 过表 达反而可以抑制 HFD 和四氯化碳诱导的脂肪变性和 肝纤维化,因此 ASK1 在 NAFLD 和纤维化过程中 可能也具有一定的保护作用。
目前在研的大部分单一靶点在 NAFL-NASH肝纤维化整体进展中的具体作用机制仍不完善,而 NASH 的发病机制涉及多种细胞、多种靶点以及不同的信号通路,部分靶点在不同的细胞中可能产生互相抵消的治疗效果,比如在保护受损伤肝细胞同 时抑制了 HSC 和 Kupffer 细胞的失活或者凋亡,这也是有些靶点治疗方案需要考虑的问题之一,因此针对现有靶点的药物开发仍有待进一步研究,而新的 NASH 发病机制的探索以及全新机制创新药物的 开发还将是 NASH 研究领域的重要方向。
4结语NASH 新靶点探索和新药研发依赖于对 NASH 相关细胞以及分子生物学机制的深入理解和认知。作为肝脏的实质性细胞肝细胞异常脂肪变开启了 NAFLD 的发生,随后的肝细胞凋亡以及炎症反应引发 NASH 特殊病理表征如气球样变,之后在 Kupffer 细胞、 LSEC、HSC 等多种非实质细胞的共同作用下进展为 肝纤维化。肝脏由最初的脂肪变到 NASH 乃至纤维 化的形成是一个非常复杂的病理生理过程,涉及到代谢、炎症、遗传等多种因素的影响,以及多种肝内和 肝外组织细胞包括先天性和获得性免疫细胞的参与和 调节。重要的是,这些过程是无法由单一细胞的作用 实现的,肝脏内不同细胞的交互作用形成了一个复杂 的交联网络和反馈体系,细胞自身受到调节同时还会 调控其他细胞。深入探索不同细胞在 NASH 中的独特作用,同时研究细胞之间相互作用的分子机制,对阐明 NASH 机制和发现治疗新靶点具有重要意义。
来源:ppsyxjz 药学进展
原文链接:https://mp.weixin.qq.com/s?__biz=MzA5MDY3ODExNQ==&mid=2651310415&idx=1&sn=c6db815b616a51c4b456153d7bb3e5f2&chksm=8bf49f43bc831655275357978c816c165003193815fc3c7cf66747218c4c0d7b223150b713a7#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn