来源:iNature
人类免疫缺陷病毒1型(HIV-1)是一类主要的HIV病毒,其选择性地侵入CD4+T淋巴细胞和单核巨噬细胞亚群,也能感染B细胞、小神经胶质细胞及骨髓干细胞,是引起获得性免疫缺陷综合征(AIDS)的主要毒株。以这HIV-1为代表的逆转录病毒的感染通常涉及病毒脱衣壳、RNA基因组逆转录成DNA,然后整合到宿主细胞基因组中。几十年来,关于逆转录病毒的脱壳都被认为发生在细胞质中,以往的研究也提出,完整的病毒核直径为61 nm,由于核孔内径为39 nm,因此无法通过核孔,并在逆转录的协同作用下,在细胞质中发生脱壳现象。不过随着研究的深入,对HIV-1生命周期的时空分期的广泛检查,帮助构建了HIV-1在细胞质或核孔复合体(NPC)中完成逆转录和脱衣壳的模型。最近一些研究也认为HIV-1的脱壳发生在核输入过程中的核膜上,但还尚未得出在细胞核中发生脱壳的结论。
2020年6月1日,AdarshDharan等人在Nature Microbiology 在线发表题为“Nuclear pore blockade reveals that HIV-1 completes reversetranscription and uncoating in the nucleus”的研究论文,该研究报道了HIV-1复制的关键过程逆转录和脱衣壳都发生在细胞核内。本研究使用了核孔复合物抑制剂,定时观察已进入感染细胞核的HIV的逆转录情况。发现,HIV在感染细胞后迅速进入细胞核进行逆转录。另外,研究还发现HIV在细胞核中仍对衣壳抑制剂PF74高度敏感,这提示HIV脱衣壳也同样发生在细胞核内。

研究者使用这种诱导性NPC阻断来确定不同靶细胞中HIV-1进入细胞核的动力学(NIK),出乎意料的观察到HIV-1以相对快速的动力学(<5 h)进入细胞核。并且HIV-1在单核细胞衍生的巨噬细胞(MDM)和CD4 +原代T细胞中进入细胞核要比HeLa细胞快得多,前者在同步感染后大约3.5小时便不受NPC阻断的影响,而HeLa细胞则需要大约7小时。
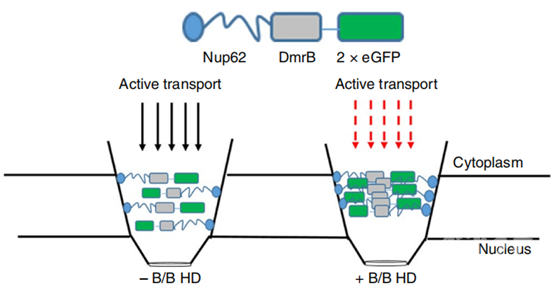
接下来,研究者进一步在核输入动力学实验的背景下使用了一种称为PF74的衣壳抑制剂来确定HIV-1组装的衣壳是否介导了病毒核输入后感染的功能作用。病毒对PF74的易感性取决于组装的衣壳,当病毒感染后若持续对PF74易感,则表明组装衣壳在随后的感染步骤中起到持续的功能作用。结果显示,在所有被检测的靶细胞中HIV-1病毒对NPC阻断不敏感后的数小时内,病毒对PF74的抑制仍保持敏感,这提示HIV脱衣壳过程也发生在细胞核内。
最后,由于已知衣壳可以介导HIV-1的核输入,并且据报道衣壳中的突变会影响感染期间使用的核输入途径,因此研究者接下来便确定衣壳突变体在多大程度上会影响HIV-1的核输入动力学。但是,含有N74D衣壳的HIV-1感染与核孔蛋白CPSF6和Nup153的结合存在缺陷。与相同靶细胞中的野生型病毒相比,不能结合亲环蛋白A的P90A衣壳对Nup62介导的NPC阻断的敏感性较弱。表明拥有这些突变体,特别是P90A突变体的HIV-1病毒在感染过程中可以通过不同的核孔复合物进入细胞核。而这也与最近提出的影响HIV-1感染和限制因子MX2抑制的NPC异质性模型是一致的。
启发与问题1.该研究中,研究者使用了可诱导的NPC阻断剂来监测同步化的HIV-1感染对NPC阻断剂敏感的速率。通过监视HIV-1感染并测量进入细胞核的能力提供了超过成像或其他生化方法的显着优势,因此可以对HIV-1感染关键方面的时空分期提供十分重要的模型基础。而该实验系统的成功应用也为定义其他病毒在细胞质和细胞核阶段的感染过程提供了有价值的经验和工具;2.N74D和P90A衣壳突变体对Nup62二聚化的相对不敏感性是研究中的另一个意外结果。虽然之前的研究普遍支持衣壳影响核输入和随后的整合位点选择方面的观点,但个别衣壳突变体的选择性阻断更具体地表明了,这些病毒可通过有不同核孔蛋白组成的不同核孔进入细胞核。核孔在核孔蛋白组成上不均匀,并介导不同物质在个体细胞内的输入,这一可能性与最近另一项关于HIV-1核输入的研究一致,但在其他方面仍未得到充分的认识和鉴定;3.研究者们还应该注意到,HIV-1感染过程中可使用的替代核输入途径或输入途径的进一步描述,以及如何开发阻断剂来阻断这些途径的类似工具?进一步的研究也将有助于更好地理解使用不同的核输入途径是如何驱动HIV-1进入细胞核?
来源:Plant_ihuman iNature
原文链接:https://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247510175&idx=6&sn=960fcc97b95dfc463b5e3335703bb7ff&chksm=fce6db40cb9152562e068701b6a0f06991ada2c2ac4b7e732ff2b6265feb72cdc21b932849b2#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



