来源:BioArt
责编 | 兮
从太上老君的炼丹炉,到谷歌建立的抗衰老公司Calico,人类对长生不老仙丹的探求始终没有停步。人类衰老和器官衰竭在分子水平上伴随着体细胞内的端粒的变短(端粒,telomere: 染色体末端的重复DNA序列)。过短的端粒会破坏基因组的稳定性,引发(干)细胞的沉睡(senescence),导致组织和器官的功能退化。因此,有效的延长端粒的药物对治疗先天性早衰、肝肺硬化(fibrosis)、神经和骨髓衰竭等短端粒疾病【1】有重要的临床价值 [例如,雄性荷尔蒙Danazol【2】];甚至还有临床试验 (Libella, LLC) 在试图通过延长端粒的方法去逆转人类的衰老进程。
端粒酶(telomerase)是人体,乃至单细胞酵母中,可以直接延长端粒的唯一分子机器。这个蛋白RNA复合体以非编码RNA亚基hTR为模板,由逆转录酶TERT去催化端粒的延长。端粒酶的活性对TERT和hTR的分子丰度非常的敏感:单拷贝TERT或hTR的失活突变会造成50%的端粒酶的下降,但也足以引发先天性的短端粒早衰病;表达外源的TERT和/或hTR在体外细胞系里足以引发端粒的延长,也证明了提高hTR的分子水平对延长端粒的可行性。hTR的调控主要发生于转录后的一系列的RNA biogenesis步骤,包括hTR转录后的修饰(PTM)和成熟【3】,细胞内的定位,以及和TERT的有效组装【4】,直至形成能够延长端粒的全酶(见下图)。
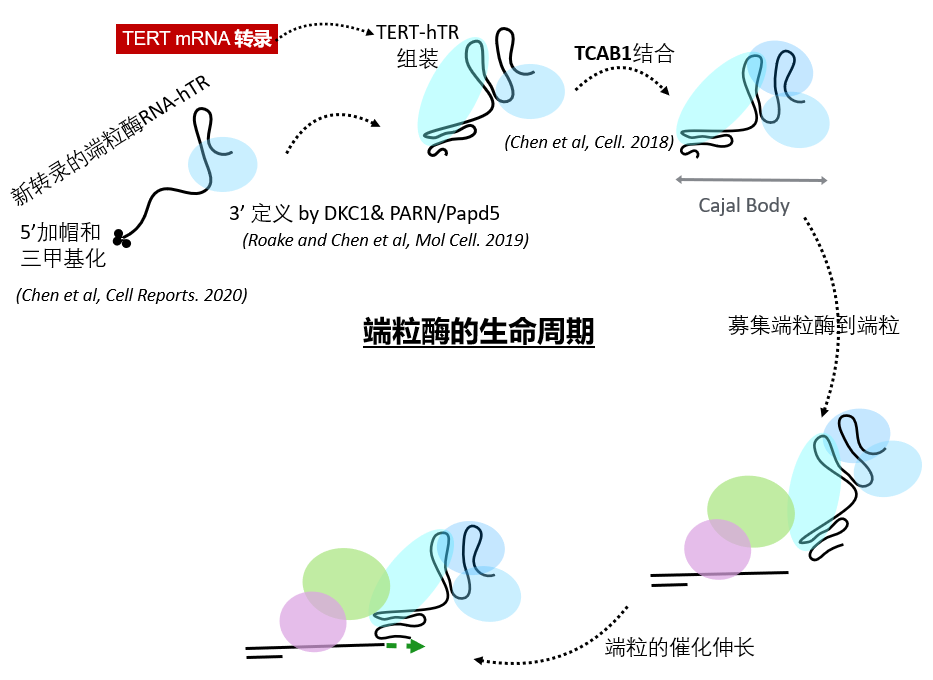
以短端粒为特质的早衰病变阐述了维持端粒长度的必须分子机理,但激活端粒酶而造成端粒延长的突变和实验报道并无先例。因此,系统性的研究端粒酶RNA亚基hTR的biogenesis 中的具体步骤可以弥补这个知识的空缺,从而为提高细胞内hTR丰度,和端粒伸长提供新的药物靶点。
端粒酶hTR和其它的RNA聚合酶II的产物一样,其5’端的非典型的鸟苷上在共转录过程中会获得单甲基化的修饰 (m7G)。信使mRNA的m7G帽会被帽结合蛋白CBP识别并介导,路经核孔转运至细胞质内来进行蛋白质翻译。但hTR和其他的非编码RNA [包括小核RNA(snRNA),小核小体RNA(snoRNA),和病毒RNA] 的m7G帽会被进一步甲基化为三甲基化鸟苷帽(m2,2,7G, TMG) 。这些RNA的细胞内转运调控与mRNA不同,其中TMG帽的修饰起了很大的作用【5】。酵母细胞里端粒酶RNA的TMG帽需要yTGS1(三甲基化鸟苷合成酶)。有意思的是,在出芽酵母和分裂酵母里分别敲除yTGS1,会导致截然相反的端粒酶RNA的水平变化,以及相反的端粒长度变化【6,7】。此外,人类细胞内hTR的TMG帽被哪个蛋白因子修饰还不清楚,而且三甲基帽对人类端粒酶和端粒长度的调控也有待进一步研究。
2020年2月5日,斯坦福大学癌症研究中心Steven E. Artandi的实验室和罗马大学Grazia D. Raffa实验室共同在Cell Reports杂志在线发表题为Loss of Human TGS1 Hypermethylase Promotes Increased Telomerase RNA and Telomere Elongation的研究论文,第一次提供证据表明在人细胞里RNA三甲基化鸟苷合成酶(TGS1) 直接修饰了端粒酶RNA (hTR) 的三甲基化帽,TGS1的缺失会导致hTR的分子丰度和端粒酶活性的等比例增加,以至于人细胞内的端粒的伸长。

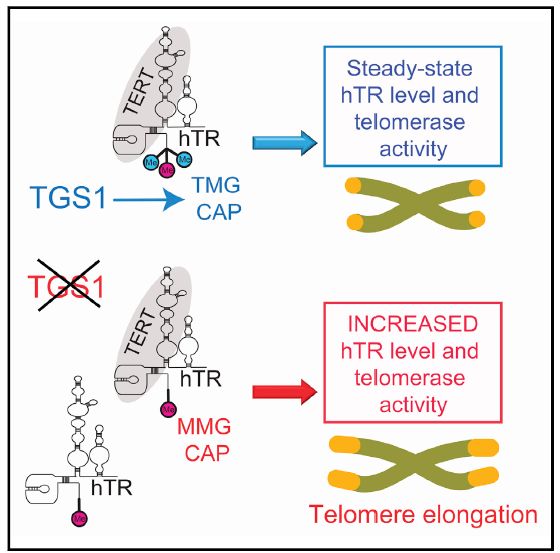
文章另外提出了端粒酶RNA (hTR) 稳定性增加和端粒伸长的分子细胞机理模型:在TGS1正常工作的人细胞里,TGS1和hTR都聚集在Cajal小体里,核小体外;hTR的5’鸟苷帽子被TGS1三甲基化后, 与帽结合蛋白CBP, RNA伴娘Sm复合体的亲和力保持较低状态。当TGS1被CRISPR失活后,hTR的5’帽子三甲基化不再,只留下单甲基化的hTR成为CBP和Sm的高亲和力结合伴侣, hTR也由CBP所介导,更多的被外送出细胞核。hTR细胞内外平衡的改变直接或间接的规避了hTR被RNA exosome识别降解的效率,因此导致了更多hTR的细胞内积累,更多的hTR和TERT在细胞核里的组装。由于Cajal小体在TGS1-KO细胞的瓦解,端粒酶大多会定位至核仁内。

作者在最后指出抑制TGS1和抑制PAPD5 (hTR 的3'端多聚腺苷酸酶)【3,8】在表型上有相似处:都是少有的能够提高hTR分子丰度和端粒酶活性,乃至端粒的伸长的分子途径。因此,TGS1的抑制为治疗由端粒酶不足引发的疾病提供新的药物靶点,并为探索延缓人类衰老提出新的思路。
原文链接:
https://doi.org/10.1016/j.celrep.2020.01.004
参考文献
1. M. Armanios, E. H. Blackburn, The telomere syndromes. Nat Rev Genet13, 693-704 (2012).
2. D. M. Townsley et al., Danazol Treatment for Telomere Diseases. The New England journal of medicine374, 1922-1931 (2016).
3. C. M. Roake et al., Disruption of Telomerase RNA Maturation Kinetics Precipitates Disease. Mol Cell74, 688-700 e683 (2019).
4. L. Chen et al., An Activity Switch in Human Telomerase Based on RNA Conformation and Shaped by TCAB1. Cell174, 218-230 e213 (2018).
5. B. Pradet-Balade et al., CRM1 controls the composition of nucleoplasmic pre-snoRNA complexes to licence them for nucleolar transport. EMBO J30, 2205-2218 (2011).
6. W. Tang, R. Kannan, M. Blanchette, P. Baumann, Telomerase RNA biogenesis involves sequential binding by Sm and Lsm complexes. Nature484, 260-264 (2012).
7. J. Franke, J. Gehlen, A. E. Ehrenhofer-Murray, Hypermethylation of yeast telomerase RNA by the snRNA and snoRNA methyltransferase Tgs1. J Cell Sci121, 3553-3560 (2008).
8. B. Boyraz et al., Posttranscriptional manipulation of TERC reverses molecular hallmarks of telomere disease. J Clin Invest126, 3377-3382 (2016).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652480717&idx=5&sn=7d6e531816b0afcb6d9f636257ad083b&chksm=84e23779b395be6f1f7f594221412b8e17b615eaeed39cb986b1db3354e31f88c7fcfa98321e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


