肿瘤细胞从原位播散到远端器官涉及多个生物学过程。目前,针对肿瘤转移尚无十分有效的预防和治疗方法。血管内皮细胞是被覆于血管内壁的单层细胞,在肿瘤血行转移过程中扮演重要角色。当受到LPS和TNFα等炎症因子刺激时,血管内皮细胞上调表达多个粘附分子,如E-selectin、VCAM-1和ICAM-1,能与肿瘤细胞上相应的配体结合,发生粘附,从而将血流中的循环肿瘤细胞(CTC)捕获,促进肿瘤细胞在远端器官定植从而发生转移。手术切除是大多数原发性实体瘤的常见治疗手段,然而,手术却也存在增加肿瘤转移的风险:手术创伤造成开放性伤口增加肿瘤细胞在血流中的扩散;手术创伤引发的系统性炎症增加血管内皮细胞对CTC的黏附,增加肿瘤细胞在远端器官定植。
中国科学院昆明动物研究所研究员陈策实团队等发现,小鼠原位瘤切除手术导致血清中炎症因子(LPS和TNFα)上升,在多种小鼠肿瘤转移模型中,血管内皮细胞缺失HECTD3泛素连接酶可显著降低乳腺癌和黑色素瘤肿瘤转移发生的概率。在小鼠原代内皮细胞和人原代脐静脉内皮细胞中敲除或者敲低HECTD3能显著下调炎症因子对粘附分子VCAM-1、ICAM-1和E-selectin的诱导表达,并抑制内皮细胞对肿瘤细胞的粘附作用。机制研究表明,HECTD3通过促进IKKα K296位点上K27-和K63-链的多聚泛素化修饰,提高IKKα的蛋白稳定性和激酶活性,增加其下游靶蛋白Histone H3的磷酸化,促进NF-κB信号通路下游靶基因(包括粘附分子和炎症因子)转录。使用IKKα激酶抑制剂可显著抑制LPS诱导的肿瘤肺转移。研究揭示了HECTD3-IKKα轴在肿瘤血行转移中的促进作用,HECTD3是首个被鉴定到的介导IKKα泛素化的E3泛素连接酶,而且这种泛素化修饰对底物蛋白的影响和传统的促进底物蛋白降解功能完全相反。该研究跳开肿瘤本身,从肿瘤细胞转移至远端靶器官的角度入手,首次揭示HECTD3在血管内皮细胞中促肿瘤转移中的分子机制,确定其作为癌症转移靶点的生物学功能。筛选针对HECTD3的特异性小分子抑制剂,可能成为一种不针对肿瘤细胞本身的防治肿瘤转移的新策略。
相关研究成果以Targeting HECTD3-IKKα axis inhibits inflammation-related metastasis为题近日发表在Signal Transduction and Targeted Therapy上。该工作得到国家重点研发计划、国家自然科学基金和中国博士后基金等项目的支持。
论文链接
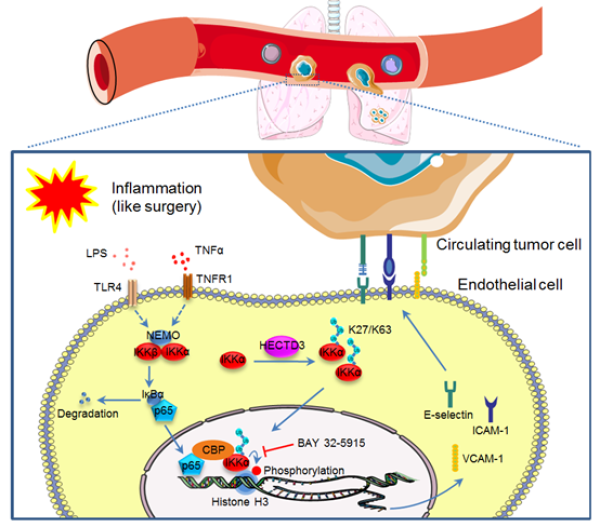
靶向HECTD3-IKKα信号轴抑制炎性相关的肿瘤转移
内容来源:中国科学院
来源:中国科学院
原文链接:http://www.cas.cn/syky/202208/t20220815_4844630.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn






