2022年08月02日,中国科学技术大学孙林峰教授团队在Nature杂志上发表了题为“Structural insights into auxin recognition and efflux by Arabidopsis PIN1”的研究论文,报道了植物中生长素极性转运蛋白PIN1单独的(apoform),与底物生长素结合的(IAA-bound),以及与抑制剂NPA(N-1-naphthylphthalamic acid,又名抑草生)结合的(NPA-bound)三个高分辨率结构,并结合功能实验阐释了PIN1蛋白的工作机制,为理解植物生长素运输调控、以及针对PIN蛋白的农业用除草剂和植物生长调节剂的设计开发提供了重要基础。
早在1880年,达尔文父子在《植物的运动力》(“The Power of Movements in Plants”)一书中,就提出了植物茎顶端会产生某种物质,导致“向光性”生长的猜想。1928年荷兰科学家F.Went通过著名的“温特实验”(燕麦胚芽鞘弯曲实验)证实了这种物质的存在并首次提出了“生长素”的概念。科学家进一步的研究确定植物中主要的生长素为吲哚-3-乙酸(IAA, Indole-3-acetic acid)。作为第一种被发现的植物激素,生长素几乎参与了植物生长发育调控的每一个过程,比如胚胎发育、根发育、叶发育、花发育、向光性和向重力性等。区别于其它植物激素,生长素的一个非常显著的特点是其细胞与细胞间的运输过程具有方向性,这一过程也被称为生长素极性运输(Polar Auxin Transport, PAT)。生长素极性运输通过与其合成和代谢途径共同配合,产生浓度梯度和局部浓度差异,建立调控植物生长发育、“向性生长”的基础,响应内外界信号刺激。在生长素极性运输过程中,位于膜上的转运蛋白发挥了关键作用,其中生长素外排蛋白家族PIN(PIN-FORMEDauxin exporter)尤为重要。研究表明,PIN蛋白成员在细胞质膜上具有不对称分布的特点,其极性定位与生长素运输方向高度关联,是生长素在植物体内不对称分布的重要原因。由于缺乏精细的三维结构,PIN家族蛋白特异性识别、转运生长素的机制一直未知,也是生长素研究领域亟待解决的关键科学问题。NPA是之前在实验室广泛应用的一种生长素极性运输抑制剂,也是农业生产中最早作为除草剂应用的化学小分子。生化证据表明,NPA可以直接靶向PIN蛋白,但是究竟是如何发挥作用的一直不清楚。
在模式植物拟南芥中,PIN家族包括8个蛋白成员,包括经典的、主要分布于细胞膜上的、具有较长胞质loop环的PIN成员(PIN1~PIN4和PIN7),非经典的、分布于内质网上的、具有较短胞质loop环的PIN成员(PIN5和PIN8),以及胞质loop环长度介于二者之间的PIN6蛋白。PIN1是最早鉴定的PIN家族成员之一,其基因突变导致植物产生裸露的针状(pin-formed)花序,该家族由此得名。在本研究中,孙林峰团队针对PIN1这一经典的PIN家族成员展开研究,首先搭建了一套全新的、基于放射性同位素和哺乳动物HEK293T细胞的、检测PIN1蛋白生长素外排功能的生化体系,不仅验证了其转运活性,证实了PIN1受蛋白激酶激活调控、被NPA抑制的过程,也为PIN介导的生长素运输机制研究提供了一种可靠的便捷手段。此外,团队还利用质谱分析技术,鉴定了多个位于胞质loop环的磷酸化位点,为进一步研究PIN受磷酸化调控的机制提供了线索。
在功能分析的同时,团队利用HEK293F细胞瞬时表达系统表达、纯化得到了拟南芥PIN1蛋白。为了解决蛋白构象不稳定及分子量较小的问题,孙林峰团队与中国科学院分子细胞科学卓越创新中心李典范团队合作,利用体外纳米抗体合成技术,得到了大量靶向PIN1蛋白的纳米抗体,进一步通过亲和力、热稳定性分析缩小了抗体筛查范围。最终,团队利用冷冻电镜单颗粒重构技术,成功解析了PIN1与一种纳米抗体结合的、分辨率为3.0埃的结构,首次揭示了经典PIN家族蛋白成员的样貌。PIN1以对称性的同源二聚体方式组装。每个PIN1单体具有10次跨膜螺旋,呈现出典型的NhaA蛋白折叠方式,划分为Scaffold结构域和Transporter结构域。PIN1呈现向细胞质侧开放的构象,同时在胞质侧,还具有一个由b折叠片组成的结构域,区别于近期报道的同家族成员PIN8蛋白的结构。通过在蛋白中添加底物IAA和抑制剂NPA,团队又分别得到了PIN1蛋白分别与两种小分子结合的复合物结构。在这些结构中,清楚地看到了IAA和NPA结合的结合位点以及相互作用氨基酸残基,并通过突变、ITC结合常数测定和转运分析验证了这些残基的重要性。虽然IAA和NPA在结合方式上具有一定相似性,但是由于NPA分子更大,通过与PIN1产生更多的氢键和疏水性相互作用,以一种亲和力更高的方式结合,并使蛋白处于朝内侧开放的构象,从实验上验证了NPA的高效抑制作用。除此之外,团队还讨论了PIN家族蛋白转运IAA的驱动力和能量来源,通过转运实验分析,发现跨膜质子梯度对于IAA运输影响较小,暗示PIN不依赖于质子梯度提供能量。
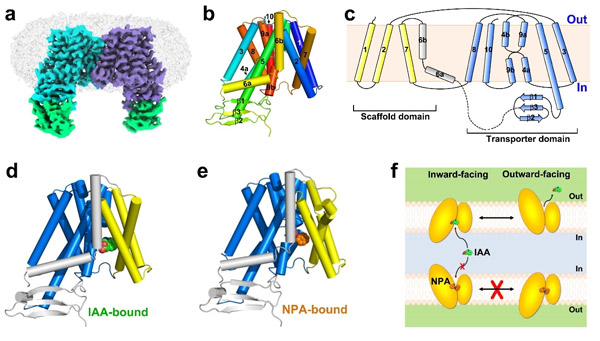
图1. 拟南芥PIN1蛋白三种状态下的结构和转运机制示意图。
综上,该研究揭开了植物经典PIN家族蛋白的结构面纱,系统阐释了PIN1识别底物生长素IAA以及被NPA抑制的分子机制,为我们深入理解植物生长素极性运输过程提供了重要帮助,也为基于靶向该家族蛋白的小分子抑制剂设计奠定了基础,对于指导农业应用具有重要意义。
中国科学技术大学生命科学与医学部杨智森、夏婧,以及中科院分子细胞科学卓越创新中心洪晶晶为该论文共同第一作者,中国科学技术大学生命科学与医学部刘欣副研究员、孙林峰教授为共同通讯作者,中科院分子细胞科学卓越创新中心李典范研究员、奥地利科学技术研究院JiříFriml教授、中国科学技术大学生命科学与医学部谭树堂教授及中科大冷冻电镜中心高永翔博士均参与了该项研究工作。该工作得到了中国科学院战略性先导科技专项基金(B类)、国家自然科学基金、安徽省自然科学基金、中央高校基础科研业务费专项资金及中国科学技术大学统筹推进世界一流大学和一流学科建设专项资金等项目的资助,以及教育部无膜细胞器与细胞动力学重点实验室、合肥微尺度物质科学国家研究中心、生物医学与健康安徽省实验室的大力支持。冷冻电镜数据收集工作在中科大冷冻电镜中心和生物物理所生物成像中心完成。
论文链接:https://www.nature.com/articles/s41586-022-05143-9
内容来源:中国科技大学合肥微物质研究中心
来源:中国科技大学合肥微物质研究中心
原文链接:http://www.hfnl.ustc.edu.cn/detail?id=19905
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn






