脂肪组织驻留调节性T(Regulatory T, Treg)细胞对维持机体免疫稳态和代谢平衡至关重要。脂肪组织微环境中,抗原、IL-33、IFN-α、胰岛素、雄性荷尔蒙等多种信号刺激下,Treg细胞表达多种独特的基因模块,并呈现出组织适应性发育和功能多样化。本项目利用单细胞ATAC测序以及可匹配的单细胞RNA和TCR测序追踪Treg细胞组织适应性发育,鉴定出具有不同生理功能的CD73hi和ST2hi脂肪组织驻留Treg细胞亚群。此外,CD73hi和ST2hi脂肪组织驻留Treg细胞亚群共享部分TCR克隆,提示亚群间存在细胞状态相互转化。
团队进一步研究发现胰岛素信号通过HIF-1α-Med23-PPAR-γ 轴线驱动CD73hi向ST2hi脂肪Treg细胞亚群转化。在Treg细胞中敲除胰岛素受体(Insr)、Hif1α或Med23等基因将下调转录因子PPAR-γ表达,并促进CD73hi脂肪Treg细胞亚群富集以及代谢产物腺苷的积累,从而改善机体胰岛素敏感性并激活米色脂肪产生。ST2hi脂肪Treg细胞亚群分泌sST2蛋白,通过中和细胞因子IL-33抑制米色脂肪产生。此项工作建立了胰岛素信号调控脂肪组织驻留Treg细胞的发育轨迹模型,揭示生理和病理环境中胰岛素信号如何调节脂肪Treg不同亚群间的动态变化和生理功能(如图所示),客观解释了之前其他国际团队以组织驻留Treg细胞整体作为研究对象时得出的相互矛盾性结果及疑惑。该发现为胰岛素抵抗性糖尿病重症患者临床免疫治疗提供了新思路新手段。
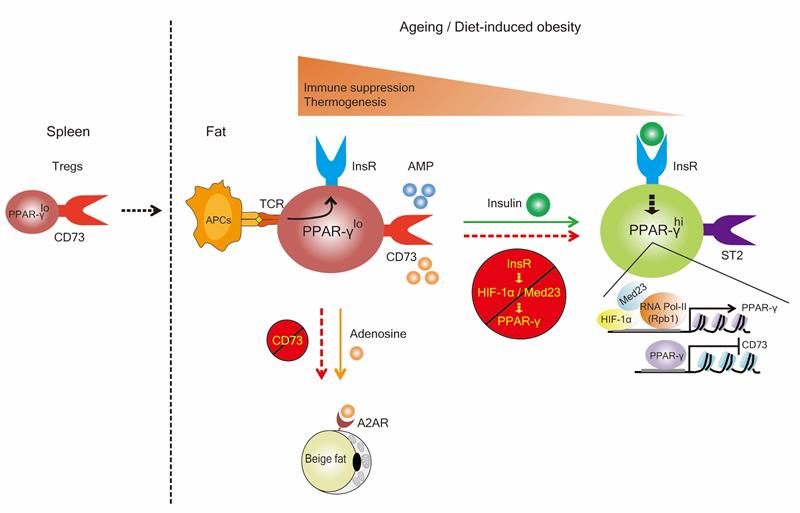
图. 胰岛素信号调控脂肪组织驻留Treg细胞的发育轨迹模型
上海市免疫学研究所博士后李扬扬和上海交通大学医学院博士后卢颖为该研究论文的共同第一作者,通讯作者为上海市免疫学研究所李斌研究员、上海交通大学医学院童雪梅研究员和复旦大学王纲教授。该项研究受到国家自然科学基金、国家重点研发计划和上海市科学技术委员会科学基金等项目资助。
原文链接:https://doi.org/10.1038/s41590-021-01010-3
内容来源:中国免疫学会
来源:中国免疫学会
原文链接:http://www.csi.org.cn/article/content/view?id=1175
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn