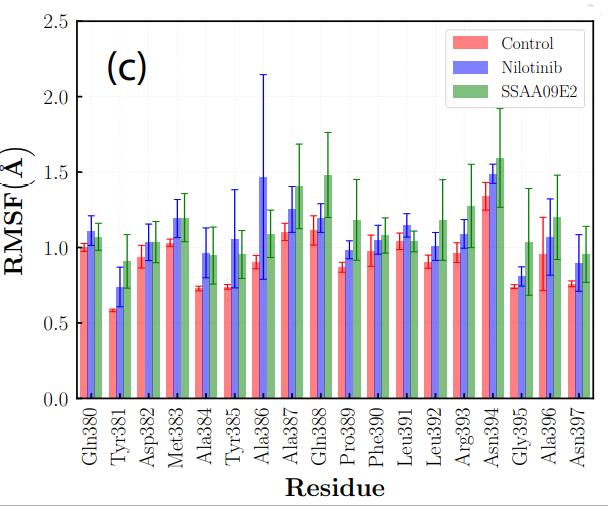
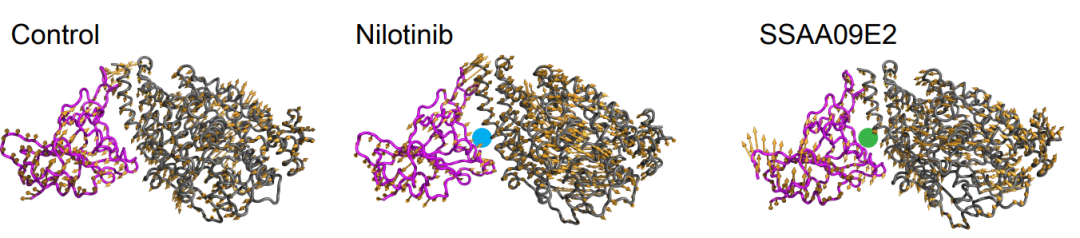
对ACE2-RBD蛋白复合体以及结合药物的三元复合体进行分子动力学模拟,分析蛋白质的稳定性及动态构象。RMSD、RMSF分析表明药物分子并不会明显改变ACE2蛋白的稳定性,但药物可以诱导单个氨基酸残基如Gln380到Asn397区域的明显改变,Arg393是ACE2-RBD的关键结合位点,药物结合导致结合自由能下降,不利于结合。此外,SSAA09E2还导致RBD结构不稳定,C端His519-Gly526区域出现较大波动。
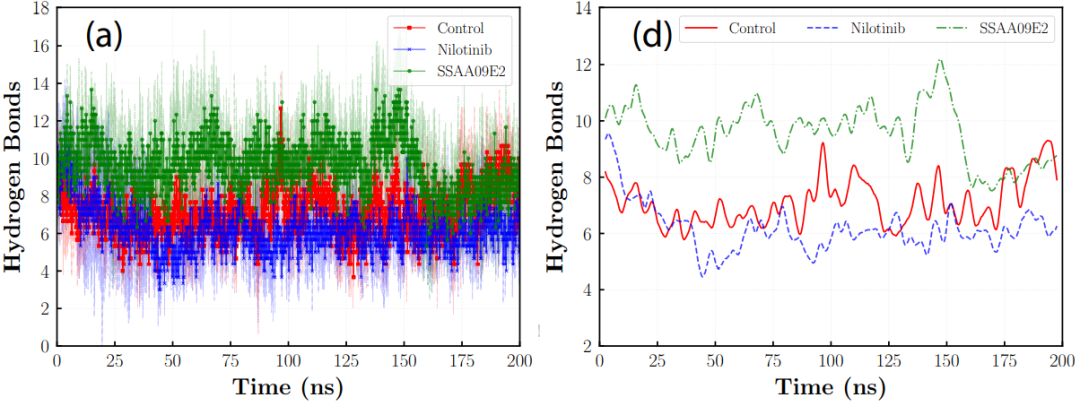
由于氢键在蛋白质-蛋白质相互作用中发挥主要作用,在SSAA09E2存在情况下,蛋白间形成更多氢键,而尼洛替尼则削弱了结构的完整性。SSAA09E2诱导ACE2-RBD复合体His34-Tyr453、Asp38-Tyr449关键残基距离缩短,相反尼洛替尼导致残基距离增加。综上,SSAA09E2使ACE2-RBD相互作用更为紧密,而尼洛替尼干扰ACE2-RBD结合。
利用主成分分析探究ACE2-RBD主要的运动机制,发现SSAA09E2通过影响局部动力学,特别是ACE2界面远端残基和环区,而尼洛替尼则是诱导不同蛋白的大尺度构象改变。
来源:病毒学界
原文链接:http://mp.weixin.qq.com/s?__biz=MzIyMzQ3NTMyMQ==&mid=2247506496&idx=2&sn=bed2227520cddc7860675f4ad9a67afa
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn