来源:BioArt
责编 | 酶美
肝癌是我国发生率较高的癌症之一,国家癌症中心公布统计数据显示,肝癌的发病率在我国排在肺癌、胃癌和结直肠癌之后,位居第四位。肝细胞癌(hepatocellular carcinoma, HCC)是肝癌中最常见的一种形式,主要风险因素包括病毒感染(HBV/HCV),酒精及非酒精性脂肪肝。小分子靶向药物索拉菲尼是肝细胞癌一线的标准治疗药物。与安慰剂相比,索拉菲尼能够延长患者总生存期的;但是该药的客观应答率伴随着药物耐受性的发生并不理想。因此,理解肝癌细胞的药物耐受机制是一个非常紧急的医学难题。
Hippo信号通路是抑制细胞生长的信号网络。哺乳动物中,Hippo信号通路上游膜蛋白受体激活,通过MST-LATS激酶级联磷酸化反应,磷酸化下游效应因子YAP和TAZ。而磷酸化后的YAP和TAZ会滞留在细胞质内被降解,降低其细胞核转录活性。因此经典Hippo信号依赖于蛋白激酶介导的磷酸化修饰该信号通路的关键分子从而实现对器官大小和体积的调控。
2019年12月17日,来自瑞士巴塞尔大学的Gerhard Christofori实验室(汤逢源博士为本文的第一作者兼共同通讯作者)在Nature Communications杂志上在线发表“LATS1 but not LATS2 represses autophagy by a kinase-independent scaffold function”,在生化和分子水平上发现并证明Hippo通路中LATS激酶在肝癌细胞中索拉菲尼耐性的作用机制。

为了研究Hippo信号通路在肝癌细胞中索拉菲尼耐药过程的作用,研究人员意外地发现LATS1(Large tumor suppressor)能促进肿瘤耐药性发生。很有意思的是,尽管Hippo领域公认LATS1 和LATS2 功能是互补的,在索拉菲尼的药物耐受中,LATS2并没有起非常重要的作用。通过一系列体外体内的实验,包括肝癌病人来源的类器官模型培养、TCGA数据库的相关性检索以及索拉菲尼临床样本的研究,研究人员验证了LATS1在肝细胞癌中的促进肿瘤耐药性的作用。
研究人员进一步分析了LATS1促进肿瘤耐药性的机制,通过RNA测序,生物信息学分析和细胞学的验证方法,他们发现LATS1可以抑制索拉菲尼诱导的细胞自噬,并且,LATS1 介导的细胞自噬(autophagy)调控并不依赖于它的蛋白激酶活性。细胞自噬是一种细胞代谢过程,主要发生在应激状态下,细胞中的细胞器以及蛋白质被自噬体包裹,并运送到溶酶体中降解的过程。细胞自噬和肿瘤发生,以及肿瘤的药物反应,耐受性存在着千丝万缕的关联。研究人员发现抑制细胞自噬可能挽救LATS1 失活引起的细胞凋亡,从而证实LATS1可以有效的抑制索拉菲尼诱导的细胞自噬性凋亡。
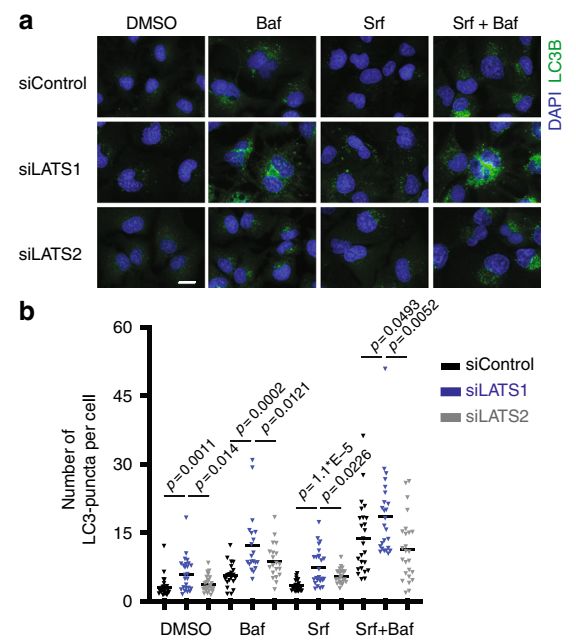
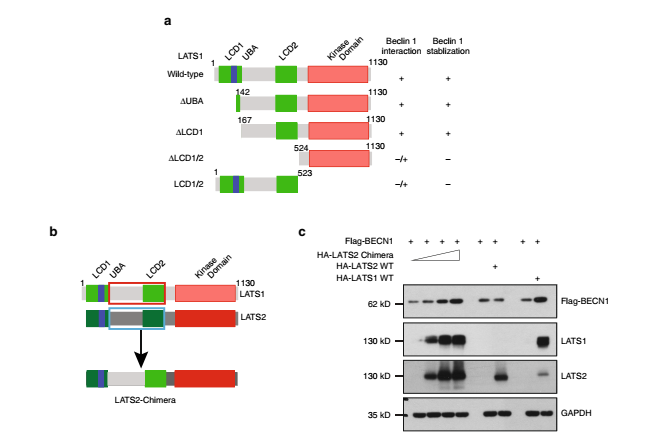
在分子机制上,研究人员发现LATS1可以结合并且在蛋白质水平上稳定细胞自噬核心蛋白Beclin-1。他们发现了LATS1和LATS2之间显而易见的功能不相关和不互补性。分子水平进一步研究表明,LATS1功能特异性是由于它特有的蛋白结构域(aa167-523),而不是由蛋白激酶活性引起的。相应的,将LATS2蛋白对应的蛋白结构域替换成LATS1来源的片段形成的嵌合性LATS2(LATS2 chimera)就能够很好的稳定Beclin-1,从而证明了LATS1特有的结构域介导了LATS1和LATS2之间的功能差异性。
蛋白质稳定性调控通常伴随着蛋白的泛素化修饰;蛋白稳定性上升时常伴随着降解性泛素化水平的下降。确实,研究人员进一步发现LATS1可调控Beclin-1的泛素化修饰,但是他们发现LATS1可以诱导并促进K27形式的Beclin-1泛素化修饰。通过质谱检测和生化验证,他们发现了赖氨酸K32和K263是两个潜在的主要泛素化位点。蛋白水平上,LATS1 介导的Beclin-1 泛素化是和LATS1 介导的Beclin-1稳定性是正相关的。在细胞水平,LATS1介导的细胞自噬以及细胞凋亡调控也是和Beclin-1泛素化是相关的。K263的K27形式的泛素化可以促进失活性的Beclin-1 二聚体产生,从而抑制细胞自噬的发生。
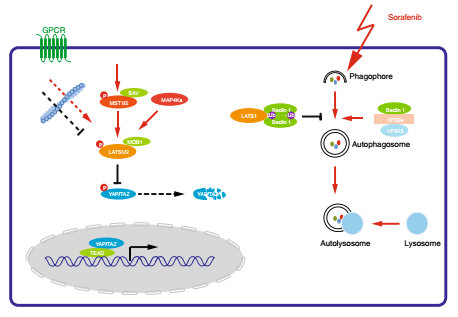
在肝癌细胞中,高表达的LATS1可以利用其特定结构域结合Beclin-1并诱导Beclin-1 赖氨酸K32和K263位点的泛素化,从而促进失活性的Beclin-1二聚体形成,最终抑制索拉菲尼诱导的细胞自噬性凋亡。该工作首次发现非激酶依赖性功能的LATS1在细胞自噬中的调控机制,并且发现LATS1在肝细胞癌中的促进肿瘤耐药性的功能,同时在分子水平分析和鉴定出LATS1和LATS2的功能差异性。
靶向Hippo信号通路是肿瘤治疗和再生医学是一个非常热门的新策略。该研究表明后续研发可能需要通盘考虑经典(蛋白激酶活性依赖性)和非经典(蛋白激酶活性非依耐性)的细胞信号传递网络从而避免意外副作用的发生。
原文链接:
https://www.nature.com/articles/s41467-019-13591-7.pdf
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479416&idx=5&sn=fb12da03cd5fc469d203649293a38459&chksm=84e20c0cb395851a57a54daf854de80419a331c330ac02f88d89fe70b6f58bb359eb5597d206&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



