来源:BioArt
撰文 | 雪月
对于肠道组织稳态来讲,入侵的肠道病原体是其主要的威胁。肠道沙门氏菌每年都引起多起死亡事件,并导致上百万人患上肠炎以及伤寒等疾病。近年来一些沙门氏菌株产生抗生素耐药,所以对于病原体和宿主的相互作用以及探索宿主主导的治疗策略都有必要投入更多的研究,以提高机体抵抗病原体能力。
胃肠道组织中的神经支配系统对于胃肠道正常功能维持非常重要。胃肠道受到来自背根神经节(dorsal root ganglion, DRG)和迷走神经节的外来神经元支配,同时也受肌层和黏膜下层的内置神经元控制【1】。其中肠道伤害感受器 (Nociceptor Neurons) 是胃肠道发生内脏痛和腹泻这些紊乱时的主要感受器,引发炎症和疼痛保护性神经反射。然而伤害感受器是否能够与肠道微生物和肠道细胞发生相互作用以及是否也参与调控肠道黏膜防御功能尚不清楚。
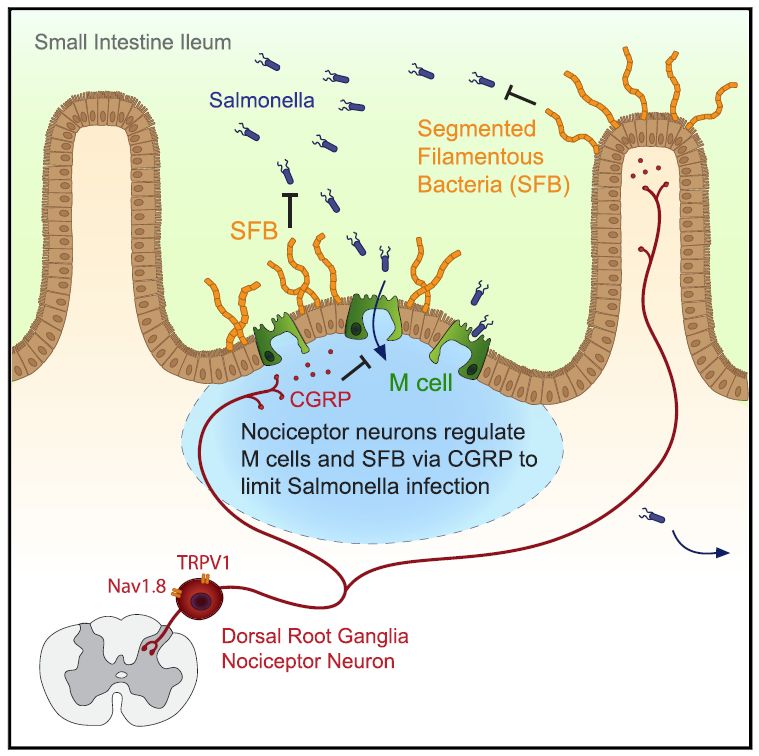
2019年12月5日,来自哈佛大学医学院的Isaac M. Chiu(大数学家丘成桐之子)的课题组在Cell期刊上发表了题为 Gut-Innervating Nociceptor Neurons Regulate Peyer’s Patch Microfold Cells and SFB Levels to Mediate Salmonella Host Defense 的文章。该文章发现背根神经节伤害感受器能够抵抗沙门氏菌鼠伤寒沙门氏菌(Salmonella enterica serovar Typhimurium, STm)肠道的定植、侵袭以及肠道的扩散。伤害感受器通过释放降钙素基因相关肽(calcitonin gene-related peptide CGRP)调控回肠潘氏结(Peyer’s patch, PP)腺泡相关上皮( follicle-associated epithelia,FAE)microfold(M)细胞和分段丝状细菌(SFB)的数量,从而限制STm入侵。SFB是一种定植于回肠绒毛和PP FAE上的肠道微生物,抵抗机体受到的STm感染。

作者首先分析了小鼠神经系统和支配胃肠道的DRG神经元两组单细胞转录组结果都发现支配肠道的神经元(不包括肌层和黏膜下层内置神经元)都会高表达Nav1.8 (voltage-gated sodium channel marking nociceptors) 和Trpv1 (encoding TRPV1, nociceptiveion channel that detects heat and capsaicin)。所以作者利用Nav1.8-Cre/DTA和Trpv1-DTR这两种DRG和迷走神经节中TRPV1+ and CGRP+神经元大量减少的小鼠口服感染STm,小鼠的病原抵抗能力明显下降。
接下来作者皮下注射resiniferatoxin (RTX),一种TRPV1激动剂处理小鼠,能够降低DRG和迷走神经节中TRPV1+和CGRP+神经元数量。之后用口服STm感染小鼠则得到了一致的实验结果。腹腔注射STm则对照组和实验组小鼠的抗感染能力未有明显区别。作者利用鞘内注射RTX降低DRG神经节数量,不影响到迷走神经节来证明是DRG神经节在抵抗病原体中发挥重要作用。
作者利用16s rRNA测序分析肠道菌群和DRG神经节的关系发现在STm感染时,去掉DRG的小鼠回肠中的STm含量最高,SFB的载量则最低。Jackson Laboratory (JAX)的小鼠的肠道没有SFB,从Taconic Biosciences来的小鼠肠道含有丰富的SFB。将SFB灌胃入JAK小鼠,再进行肠道感染STm发现,肠道中的SFB能够抵抗STm感染。通过扫描电镜发现SFB大量定植在回肠潘氏结中的FAE,STm较小的棒状细菌则粘附在附近的黏液中。作者接下来利用RTX处理JAK来源的小鼠验证了伤害感受器通过控制SFB数量来阻碍STm的定植和侵袭。
有报道称STm通过潘氏结中的M细胞作为侵袭点【2】。实验中发现在DRG神经节减少时,潘氏结中M细胞数量以及M细胞标志物GP2表达都增多。作者注射αRANKL(M细胞分化必需RANKL信号)抗体去除M细胞。去除M细胞能够增加七倍潘氏结中SFB的载量。利用RANKIEC-KO的小鼠证明伤害感受器通过调控M细胞数量来抵抗STm的感染。M细胞的去除能够恢复伤害感受器的减少导致的宿主抵抗能力降低。进一步分析发现伤害感受器不会影响免疫细胞和上皮细胞的功能。将DRG神经元体外培养发现,STm能够刺激神经元钙离子内流,导致神经元释放神经肽CGRP。染色发现CGRP阳性的神经纤维定位在潘氏结FAE的GP2阳性的M细胞附近。用CGRP的两个亚型CGRPα和CGRPβ敲除的小鼠发现是CGRPα介导了伤害感受器调控M细胞和SFB载量,从而促进机体对STm感染的抵抗能力【3】。
本研究揭示了伤害感受神经元通过与肠道菌群和肠道组织中的细胞相互作用,从而在感知和防御肠道病原体中的重要作用。这篇文章也表明神经元及其介质的操控可能是治疗肠道炎性和感染性疾病潜在靶点。
原文链接:
https://doi.org/10.1016/j.cell.2019.11.014
参考文献
1. Lomax AE, Linden DR, Mawe GM, Sharkey KA. Effects of gastrointestinal inflammation on enteroendocrine cells and enteric neural reflex circuits. Autonomic neuroscience : basic & clinical 2006; 126-127: 250-257; doi 10.1016/j.autneu.2006.02.015.
2. Jepson MA, Clark MA. The role of M cells in Salmonella infection. Microbes and infection 2001; 3(14-15): 1183-1190; doi 10.1016/s1286-4579(01)01478-2.
3. Russell FA, King R, Smillie SJ, Kodji X, Brain SD. Calcitonin gene-related peptide: physiology and pathophysiology. Physiological reviews 2014; 94(4): 1099-1142; doi 10.1152/physrev.00034.2013.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652478604&idx=1&sn=cf9bd30b49ca1bb72864858ab76faf20&chksm=84e20f38b395862e6a40f58528c58705a837995f67f0f4f9427d1b1bf85875f78aa21c90f839&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


