来源:宏基因组
乳酸菌对酸和胆碱盐的耐受能力
The Tolerance of Lactic Acid Bacteria to Acid and Choline Salts
李琴心,齐益宁 ,陈雨薇,尹佳*
生命科学学院,湖南师范大学,长沙,湖南省
*通讯作者邮箱: jiayin@hunnu.edu.cn
摘要:益生菌菌株的理想特性之一是在低pH值和牛胆汁的存在下生存和生长,同时需要通过胆盐的胃酸性环境和结肠碱性环境在小肠中生存。本文介绍了怎样评估乳酸菌对酸和胆碱的耐受能力以及在体外模拟胃肠道的情况下,通过比较低pH环境和高胆汁浓度环境,评价乳酸菌菌株作为益生菌的可行性。
关键词: 乳酸菌,耐酸耐胆碱性,模拟胃肠道 ,体外
材料与试剂
1.离心管
2.胰蛋白胨(生工,A505250)
3.酵母粉(生工,A515245 酵母提取物)
4.氯化钠(上海沪试)
5.琼脂(生工,A505255)
6.LB肉汤培养基(生工,A507002)
7.MRS肉汤培养基(赛默飞,CM1175)
8.pH计
9.0.45滤膜
10.胰蛋白酶(国药,64008860)
11.胃蛋白酶(生工,A600688-0100)
12.牛胆碱(西格玛,B8631)
13.生理盐水(医用)
仪器设备
1.量筒
2.玻璃棒
3.离心机(艾本德5424)
4.紫外分光光度计(北京普析)
5.90mm塑料培养皿(biosharp BS-90-D)
6.纯水制备仪(ELGA PURELAB系列)
7.移液器(Eppendorf Research plus 单道固定量程移液器)
8.吸头(生工,F601227)
9.烘箱(天津泰斯特101-0AB型电热鼓风干燥箱)
10.厌氧培养箱(Whitley,DG250)
11.超净工作台(天津泰斯特,CJ-2D)
12.10μl接种环(生工,F619312)
13.高压灭菌锅(上海庆开,GI54TW)
14.冰箱(美菱)
15.摇床(Eppendorf ThermoMixer C恒温混匀仪)
软件
1.Excel
实验步骤
一、益生菌的引种
1.实验用的乳酸菌可以是从自然界或者经加工的产品中分离出来,需保证菌种的纯洁性,无微生物污染。确定菌种之后,可以提取基因组DNA,结合 PCR 及 DNA 测序,BLAST分析进一步确认菌种的纯度,检测其生长情况,是否传代正常。
二、测试益生菌对酸和胆碱的耐受能力
1.试剂的配制
1.1用1M HCl分别调节MRS培养液的pH值至2.0,3.0,4.0,115 ℃高压蒸汽灭菌20 min,保温至合适温度备用。
1.2在MRS液体培养基中分别加入0%、0.1%、0.3%和0.5% (w/v)的牛胆碱,充分振荡,使牛胆碱完全溶解。灭菌,保温至合适温度备用。
2.菌种的准备
2.1从﹣80 ℃冰箱将菌保取出置于冰盒中,用无菌接种环采用平板划线的方式将菌种接种到MRS固体培养基上,于37 ℃恒温箱倒置过夜培养。
2.2注意:菌保拿出后要及时放回去,以免损失菌的活性。
2.3从平板上挑取单克隆。用灭菌牙签或者枪头挑取平板上由单个菌生长成的单菌落,置于装有1 ml培养基的1.5 ml或者2.0 ml的微型离心管里,摇晃牙签或吹打混匀菌液,并做好标记,将离心管放于37 ℃,900 rpm的恒温混匀仪上培养。
2.4菌种活化。18 h后,吸取100 μl菌液转移至含900 μl MRS液体培养基的微型离心管中继续培养18 h,重复此操作两次。目的是提高乳酸菌活性。
2.5扩大培养。将在微型离心管中培养的菌液转入装有50 ml MRS液体培养基的灭菌小锥形瓶中,37 ℃培养箱培养18 h。
注:全过程都要在超净工作台上进行,需要严格无菌操作。
3.检测对酸和胆盐的耐受程度
3.1将已保温的调节好pH的培养液和加入了牛胆碱的MRS培养液放入超净工作台,每种培养液分装900 μl × 3管至灭菌的微型离心管中,并做好标记。
3.2将小锥形瓶中的菌液倒入已灭菌的离心管中,充分混匀,每个离心管中接入适量菌液,使菌液在OD = 600 nm下的吸光度在0.2 - 0.8之间(此区间内OD值与浓度成正比例),振荡混匀,放入培养箱中培养12 h。
3.3以未接菌液的培养液为对照,测量培养12 h后菌液的OD值
3.4计算成活率:Survival (%) = OD(实验组)× 100%/ OD(对照组)[1]
4.体外模拟胃肠道检测对酸和胆碱盐的耐受性
4.1将培养的实验菌株以3000 rpm的速度离心10 min,弃上清,重悬于等体积模拟胃液中并立即进行平板活菌计数,37 ℃培养3 h后第二次进行平板活菌计数。
4.2将耐酸3 h后的菌悬液以3000 rpm的速度离心10 min,弃上清,重悬于等体积的模拟肠液中,37 ℃培养2 h进行平板活菌计数,继续培养2 h进行最后一次平板活菌计数。[2]
注:平板上所长菌落需在30 - 300之间才为有效。
结果与分析
1.检测对酸和胆盐的耐受程度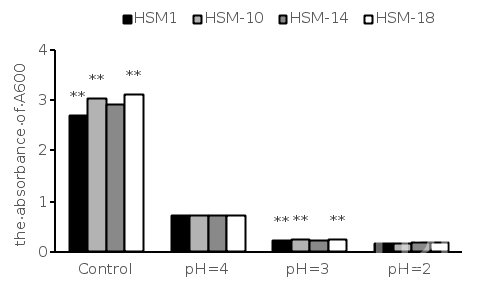
图1. 4株乳酸菌在酸性pH条件下培养12 h后的存活状况[3]
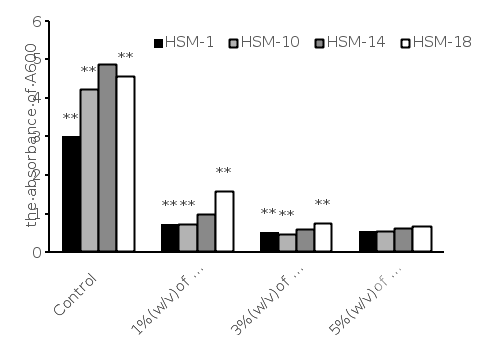
图2. 4株乳酸菌在不同胆碱盐条件下培养12 h的存活情况[3]
1.1 在低pH值和牛胆汁存在下存活和生长是乳酸菌益生菌菌株可取的特性。人的大肠含有胆盐,其浓度在0.3% ~ 0.5%之间。一般来说,胃液的pH值取决于摄食时间和饮食,可能在1.5 ~ 4.5之间变化。在低pH值和牛胆汁存在下的生长和存活被认为是未来益生菌菌株最理想的特性。
1.2 乳酸菌菌株在2.0、3.0和4.0的pH条件下,37 ℃在MRS液体培养基中培养12 h,以确定其耐酸能力(图1)。HSM-1、HSM-10、HSM-14和HSM-18在pH 4.0的MRS条件下生长效果最好(分别为27.33%、24.27%、25.22%和23.75%)。将MRS液体培养基的pH为3.0时,存活率为8% ~ 9%,继续降低MRS液体培养基pH为2.0时,存活率为6% ~ 7%。为了评估受试乳酸菌菌株对胆碱盐的耐受性,四株菌株分别用0.1%,0.3%和0.5%的牛胆碱处理,并在37 ℃孵育12 h。四株菌株对不同浓度的牛胆碱均有抗性。随着牛胆碱的增加,细菌存活率下降(图2)。
1.3 综上所述,HSM-1、HSM-10、HSM-14和HSM-18在低pH和牛胆汁条件下均有生长和存活的能力,表明这些菌株能够耐受胃肠道环境条件。
2.体外模拟胃肠道检测对酸和胆碱盐的耐受性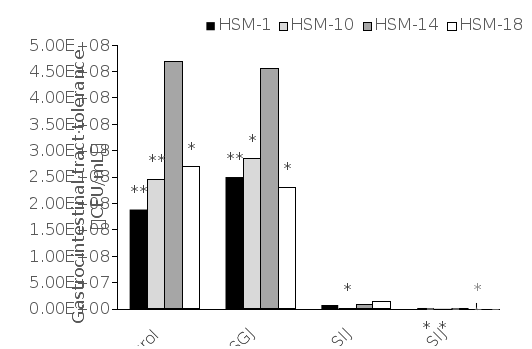
图3. 4株乳酸菌在体外模拟胃肠道条件下的存活情况[3]
2.1 益生菌需要通过胃的酸性环境和结肠的碱性环境抵抗胆盐在小肠中生存。胃液pH在3.0左右,胃消化可以持续3 h。根据前期研究报道,筛选益生菌耐酸性的标准是在pH为3.0的条件下持续培养3 h。人胆汁的生理浓度在0.3% ~ 0.5%之间,食物通过小肠的时间约为4 h,胆汁的平均浓度为0.3%。通过模拟胃肠道环境,比较低pH环境和高胆汁浓度环境,评价实验菌株作为益生菌的可行性。
2.2 4株乳酸菌菌株经过3 h的模拟胃液处理和4 h的模拟胰液处理后的存活率如图3所示。这4株乳酸菌菌株在模拟胃液中培养3 h后存活率都很高。结果显示,随着培养时间的增长,四株乳酸菌的存活率下降。
2.3 在pH 3.0时,HSM-1和HSM-10的存活率分别提高了0.125Log10 CFU/mL和0.064Log10 CFU/mL,生存率高于100%,而HSM-14和HSM-18的存活率分别降低了0.012Log10 CFU/mL和0.065Log10 CFU/mL。此外,所有4株乳酸菌菌株在模拟胰液中存活率均下降。暴露于模拟胰液 4 h后,HSM-1的存活率下降最大,约为3.208 Log10 CFU/mL,其次是HSM-10下降3.186Log10 CFU/ml SM-14和HSM-18分别下降2.28Log10 CFU/ml .674Log10 CFU/ml这四种菌株中,HSM-1对胆盐最耐受。鉴于不同的生存率,HSM-14的变异趋势最小,说明其在模拟胃肠道环境中生存能力最强。
溶液配方
1.MRS固体培养基1000 mL
序号
试剂
质量/体积
1
MRS培养基粉末
52 g
2
琼脂粉
14.4 g
2.MRS液体培养基1000 mL
序号
试剂
质量/体积
1
MRS培养基粉末
52 g
注:MRS培养基灭菌温度为115 ℃、20 min,锥形瓶等灭菌温度为120 ℃、20 min。
3.模拟胃液100 ml
序号
试剂
质量/体积
1
生理盐水
100 mL
2
0.1 mol/L HCl
1.01 mL
3
胃蛋白酶
0.3 g
注:用调节生理盐水(质量分数为0.9%)的pH至3.0,灭菌后加入胃蛋白酶,由于生理盐水的实际pH值与理论pH可能不一致,实际用于调节pH所用的0.1 mol/L HCl的量与理论可能存在偏差。
4.模拟胰液100 ml:
序号
试剂
质量/体积
1
生理盐水
100 mL
2
0.1 mol/L NaOH
1.01 mL
3
牛胆碱
0.9 g
4
胰蛋白酶
0.1 g
注:调节生理盐水(质量分数为0.9%)的pH至8.0,灭菌后加入胰蛋白酶,随后加入牛胆碱并使其充分溶解。由于生理盐水的实际pH值与理论pH可能不一致,实际用于调节pH所用的0.1 mol/L NaOH的量与理论可能存在偏差。
致谢
感谢国家自然科学基金青年项目(31700004),全国大学生平台创新和创业培训项目(S202010542046),湖南省科技厅创新人才与平台计划(2019RS5001),湖南创新型省份建设专项经费(2019RS3022)的支持。
参考文献
1.Azat, R., Liu, Y., Li, W., Kayir, A., Lin, D. B., Zhou, W. W. and Zheng, X. D. (2016). Probiotic properties of lactic acid bacteria isolated from traditionally fermented Xinjiang cheese. ournal of Zhejiang University. Science. B, 17(8), 597–609.
2.Corcoran, B. M., Stanton, C., Fitzgerald, G. F. andRoss, R. P. (2005). Survival of probiotic lactobacilli in acidic environments is enhanced in the presence of metabolizable sugars. Applied and environmental microbiology, 71(6), 3060-3067.
3.Chen, T., Wang, L., Li, Q., Long, Y., Lin, Y., Yin, J., Zeng, Y., Huang, L., Yao, T., Abbasi, M. N. et al. (2020). Functional probiotics of lactic acid bacteria from Hu sheep milk. BMC microbiology, 20(1), 228.
原文链接:http://mp.weixin.qq.com/s?__biz=MzUzMjA4Njc1MA==&mid=2247498800&idx=2&sn=379e916e9ad2af27f086c81f7862dc9e
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

