来源:中国生物技术网
近日,发表在《Nature》上的一篇研究中,来自德国神经退行性疾病中心(DZNE)和波恩大学领导的国际研究团队发现了一种炎症机制,似乎在阿尔茨海默症(AD)和其他脑部疾病的毒性tau蛋白形成过程中发挥了关键作用。

AD是老年痴呆症的最常见原因。其他的痴呆症还包括血管性痴呆、路易体痴呆和额颞叶痴呆(FTD)。
这一新发现的机制涉及一种名为NLRP3炎性小体的蛋白质复合物。过去的研究已经确认了这种大分子在触发大脑免疫细胞中炎症物质方面的重要作用。
在这项新研究中,该研究团队对NLRP3炎性小体在AD和FTD中的作用进行了研究。他们对FTD患者和非FTD患者的死后大脑样本进行了测试,还使用了培养的脑细胞和具有AD和FTD特征性脑功能的小鼠。
在这篇论文中,该研究首席研究员、波恩大学教授、神经退行性疾病和老年精神病学系主任Michael T. Heneka及其团队描述了tau蛋白如何在大脑免疫系统炎症过程的影响下发生转变。
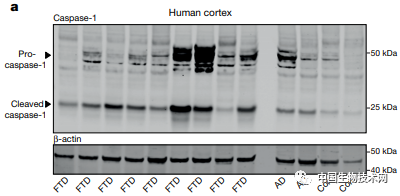
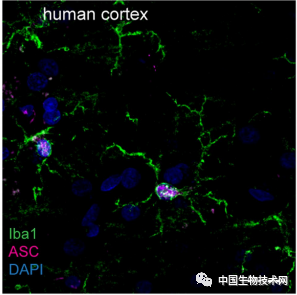
图片来源:Nature
tau蛋白在健康大脑中发挥的功能之一是帮助稳定神经细胞(神经元)的骨架。但是,在发生AD和FTD时,tau蛋白发生化学变化,使它们脱离细胞骨架并相互粘附。没有了机械稳定性,细胞最终会死亡。
过度磷酸化
使tau蛋白与细胞骨架分离并彼此粘附的原因是一种被称为过度磷酸化的过程,该过程改变了蛋白质分子的化学组成和行为。
磷酸化是细胞中蛋白质活性的关键调控因子。它涉及蛋白质分子上磷酸根(PO4)的添加和去除。
过度磷酸化意味着蛋白质分子被添加的磷酸根(PO4)基团饱和。在这种状态下,蛋白质的行为可能与正常情况完全不同。
这项新发现表明,NLRP3炎性小体触发了使tau蛋白过度磷酸化的酶,以致其脱离细胞骨架并形成团块。
Heneka教授说:“似乎由炎性体介导的炎症过程对于大多数具有tau病理的神经退行性疾病也至关重要。”
研究团队认为该机制与阿尔茨海默症严重相关。该疾病有两个显着特征:在脑细胞之间形成的β-淀粉样蛋白毒性斑块和在细胞内部形成的tau蛋白团块缠结。
此外,在tau蛋白开始形成团块之前的AD早期阶段,β-淀粉样蛋白斑块就开始形成了。
一些研究团队先前的研究已经表明NLRP3炎性小体是β-淀粉样蛋白积聚的促进剂。
β-淀粉样蛋白和tau蛋白之间
将两组发现结合在一起,可以发现NLRP3炎性小体是形成β-淀粉样蛋白斑块和tau缠结的共同因素。
Heneka教授解释说:“我们的结果支持了与阿尔茨海默症发展相关的淀粉样蛋白级联假说。根据这一假说,β-淀粉样蛋白的沉积最终导致tau病理的发展,从而导致细胞死亡。”
他认为,炎性小体是连接β-淀粉样蛋白和tau蛋白疾病过程的决定性缺失环节。 他说:“可以说它是β-淀粉样蛋白和tau蛋白之间的接力棒。”
该研究团队认为,这些发现将带来靶向tau蛋白转化过程的AD和FTD的新疗法。
Heneka教授认为,应该有可能通过改变免疫反应来开发针对tau病理学的药物。
他说:“随着tau病理的进展,人的思维能力越来越弱。因此,如果可以遏制tau病变,这将是迈向更好治疗的重要一步。”
来源:biotech-china 中国生物技术网
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5ODU5NDgyMg==&mid=2653945846&idx=1&sn=80625ab5b44589e208159c3dd74a7186&chksm=bd130f9f8a648689172687d1b9fe9e0d0b947f92db620d529ad0a105917fa897f941a7db5aa3&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn