来源:中国生物技术网
人类等高等哺乳动物基因组中包含大量长非编码RNA(lncRNA),其中绝大多数功能未知。在数万个lncRNA中,近年来的研究发现了数百个与多种细胞过程与生理功能相关的lncRNA,但在核心细胞过程中不可或缺,起决定性关键作用的lncRNA仍然非常少见。
lncRNA种类繁多,功能复杂多样,缺乏研究基础与先验知识,因此在许多生物医学研究中,面对众多未知功能的lncRNA往往无从下手,难以快速产生可验证且具有较大原创性的科学假说。杨雪瑞课题组的一个重要研究方向致力于癌症系统生物学方法的开发。针对lncRNA功能研究的现实问题,他们聚焦肿瘤体系,使用公开的多种癌症大队列组学数据,系统分析了上千个lncRNA对于肿瘤中转录调控通路的影响,以此作为lncRNA生理功能的量化指标,并进行优先级排序。
此前,实验室已经使用类似的策略系统研究了单个lncRNA或RNA结合蛋白及全基因组的DNA甲基化位点参与的转录调控系统(Cell Reports,2019),并以此为基础发现HNRNPC蛋白在乳腺癌细胞中控制内含子Alu加工及內源双链RNA的累积并调控细胞免疫反应(The EMBO Journal,2018),发现lncRNA NEAT1通过控制转录因子AGRN驱动前列腺癌细胞周期(Cancer Research,2018)。
2021年1月11日,杨雪瑞实验室在 Cell Research 杂志发表了题为:Mutual dependency between lncRNA LETN and protein NPM1 in controlling the nucleolar structure and functions sustaining cell proliferation(长非编码RNA LETN与蛋白NPM1的互作控制核仁结构与功能以维持细胞增殖)的研究论文。
研究团队首次发现了一个对于高增殖率细胞的核仁结构及功能至关重要的lncRNA,并将其命名为LETN。研究还揭示了lncRNA LETN 与其互作蛋白NPM1之间的共进化关系,对于未来的lncRNA功能研究具有高度的启发性。 在这项研究中,杨雪瑞实验室基于肝癌多组学队列数据的计算分析发现RP11-196G18.22在所有lncRNA中排名第一,显著区别于所有其它lncRNA,表现出非常强大且全局性的影响力。
在这项研究中,杨雪瑞实验室基于肝癌多组学队列数据的计算分析发现RP11-196G18.22在所有lncRNA中排名第一,显著区别于所有其它lncRNA,表现出非常强大且全局性的影响力。
在这一线索的启发下,研究团队针对RP11-196G18.22展开了全面深入的功能与机制研究,最终发现其与NPM1蛋白互作,在高增殖细胞中扮演着不可或缺的关键角色,并将其更名为LETN(lncRNA essential for tumor cell proliferation via NPM1)。
该研究发现LETN表达水平在多种肿瘤中上调,其通过与核仁蛋白NPM1的直接结合驻留在核仁中,并在促进NPM1五聚体的形成中起着至关重要的作用。
核仁是真核细胞中非常重要的无膜细胞器,是核糖体RNA的转录、加工以及核糖体亚基组装的场所,控制了细胞蛋白质合成、有丝分裂、压力应激等多种生物学功能。肿瘤细胞及神经前体细胞等快速增殖的细胞高度依赖于活跃的核仁功能,而核仁的功能与结构依赖于NPM1五聚体的形成。因此,LETN通过控制NPM1的寡聚化组装,控制了核仁的正常形态与细胞功能,包括核糖体RNA合成及染色质凝聚等。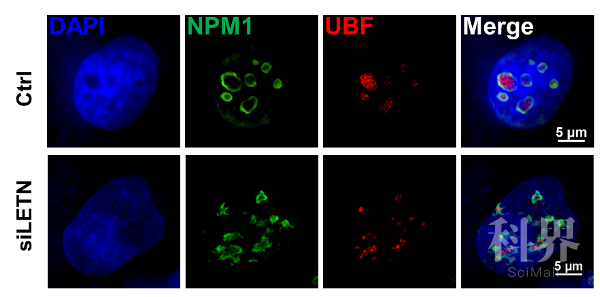
LETN的敲低严重破坏核仁中NPM1的组装分布
更进一步,从进化的角度看,LETN仅在人类及其它高等灵长类动物中出现,而NPM1蛋白也在高等灵长类动物中存在两个特异的氨基酸位点突变。论文发现正是这两个位点的突变导致NPM1产生对非编码RNA LETN的高度依赖性。因此,论文提出LETN与NPM1可能存在共进化关系,这使得人类细胞的核仁调控出现了由lncRNA LETN执行的新的调控层级。
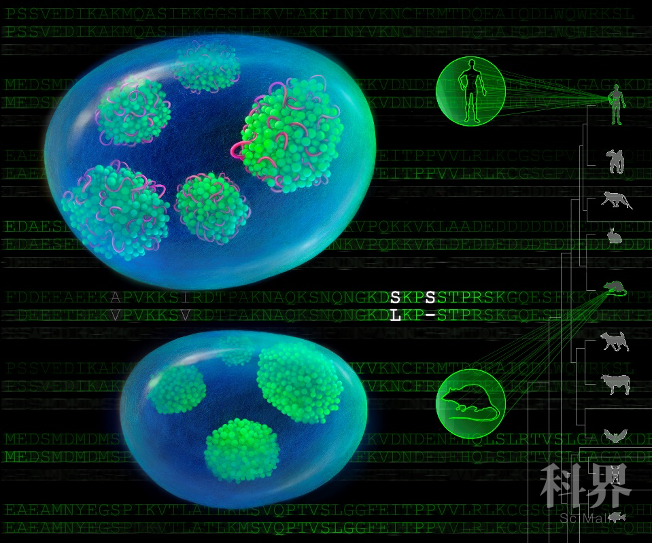
NPM1蛋白两个位点的人鼠差异导致人类细胞核仁中特异的LETN-NPM1互作
来源:biotech-china 中国生物技术网
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5ODU5NDgyMg==&mid=2653960685&idx=6&sn=15ebf361a214de9e042c01f15d9359b4
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn