来源:植物科学最前沿
2020年11月9日,奥地利科学技术研究院Jiří Friml课题组在国际著名期刊Molecular plant发表题为“Pho-view of Auxin: Reversible Protein Phosphorylation in Auxin Biosynthesis, Transport and Signaling”的综述文章。对生长素合成、极性运输和信号转导过程中的磷酸化和去磷酸化反应进行了详细阐述。

文章思维导图
研究背景
植物激素生长素作为植物生命活动需求的最基本的激素物质,在植物的器官发生、向性反应、形态建成等多方面发挥重要作用。目前,生长素合成、极性运输和信号转导框架的核心分子构成已被鉴定。蛋白激酶和蛋白磷酸酶参与其中。磷酸化和去磷酸化过程中涉及的转录因子、转运蛋白和酶类作为生长素作用过程的关键调节剂发挥作用。
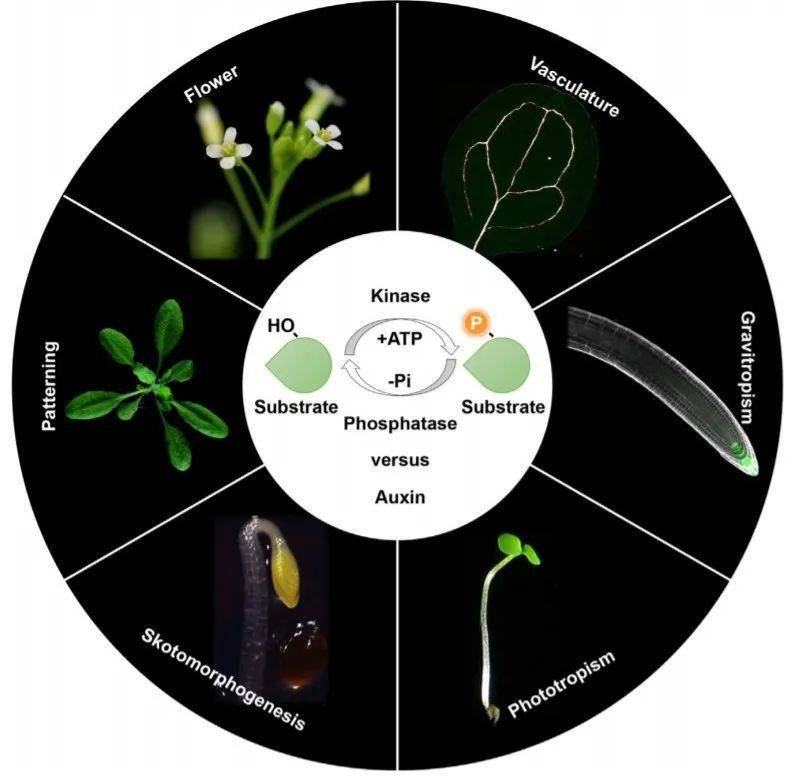
图1 植物生长素和可逆磷酸化过程。
主要研究内容
1. 生长素合成过程的蛋白磷酸化
植物体内主要的生长素合成途径为indole-3-pyruvic acid途径(IPA途径)。在该途径中,Trp主要经过TAA1/TARs和YUCCA(YUCs)催化的两步酶促反应生成IAA。近期研究报道跨膜激酶TMK4是负责TAA1 T101位点磷酸化的激酶,磷酸化后可抑制TAA1的酶活性,并影响拟南芥根分生组织大小和根毛的发育。重要的是,TMK4所介导的磷酸化过程是具有生长素响应的,作为生长素的负反馈回路发挥作用[1]。蛋白质组学数据库显示,YUC家族的成员也受到磷酸化作用[2]。但是,负责YUC磷酸化的激酶及其机理意义等还未有太多文章报道。
2. 生长素运输过程的蛋白磷酸化
细胞间生长素运输对于建立和维持局部生长素浓度至关重要。主要的生长素转运蛋白包括:PIN,ATP结合盒转运蛋白(ABCB)以及AUXIN1(AUX1)/LIKE AUXIN1(LAX)转运蛋白。除此之外,PIN-LIKES (PILS)以及WAT1蛋白也涉及到生长素的运输。
2.1 PID/WAGs-MELs作为顶端-基部PIN蛋白极性调节子
(1)拟南芥pid突变体展现出pin1相类似的表型。进一步的遗传学和生化实验表明,PID及其同源蛋白WAGs作为磷酸化开关,控制PIN1、PIN2和PIN4蛋白的极性,进而调控茎和根中细胞间生长素运输的方向性[3-6]。此外,PID/WAGs还调节下胚轴向光性过程以及茎和根的向重力过程中PIN3蛋白的重新定位(图2)。(2)PID介导的磷酸化过程除了影响PIN蛋白的极性外,还增加了PIN蛋白的转运活性[7-8]。除此之外,PID还可以磷酸化并激活ABCB1生长素转运体。最近研究表明,PID磷酸化COP1,参与植物的光形态建成的过程。2.2 D6PKs和PAX作为PIN活性调节蛋白
(1)D6PKs是AGC激酶,与非极性的PID不同,该蛋白会在质膜的基底部积累。非洲爪蟾卵母细胞的转运实验结果显示,当D6PK与PID共表达时,PIN转运活性会增强[7]。(2)PAX蛋白激酶,与D6PKs相类似,也是另外一种AGC激酶。PAX在原生韧皮部特异表达。BRX抑制PAX和D6PK的激酶活性。BRX和PAX一起招募磷酸激酶PIP5Ks, 促进PIN1的内吞,决定PIN1在质膜上的定位(图2)[9]。2.3 其他涉及生长素运输及PIN调节的AGC激酶
向光素是一类蓝光受体蛋白。其激酶结构并不能磷酸化PIN蛋白;但是蓝光受体很容易磷酸化ABCB19,干扰其转运活性[10]。向光素蛋白可以磷酸化NPH3和RPT2,两种蛋白能够调节ABCB蛋白的活性[11]。
2.4 脂类在调节AGC和PIN磷酸化中的作用
3'-磷酸肌醇依赖性蛋白激酶1(PDK1)代表真核生物中AGC激酶的主要调控因子。近期研究发现PDK1和AGC激酶与膜结构域的关联取决于脂质组成,从而将PDK-AGC激酶调节模块确立为脂质依赖性磷酸开关,进而控制PIN蛋白的活性[12]。
2.5 其他涉及PIN磷酸化的蛋白激酶
(1)在分支的调控过程,MKK7–MPK6模块的PIN1磷酸化显得至关重要,因为它调节PIN的细胞内分布,进而调节极性生长素的运输。(2)蛋白激酶MPK识别的PIN磷酸化位点的保守序列似乎与AGC型激酶识别位点相重叠,但是MPK磷酸化不会影响PIN的定位。(3)CRK5编码另一种蛋白激酶,能够使PIN2磷酸化,调控根向重力的功能。最近的研究表明CRK5能够直接磷酸化PIN3蛋白,参与顶端弯钩的发育;磷酸化PIN1蛋白,参与胚的发育[13-14]。
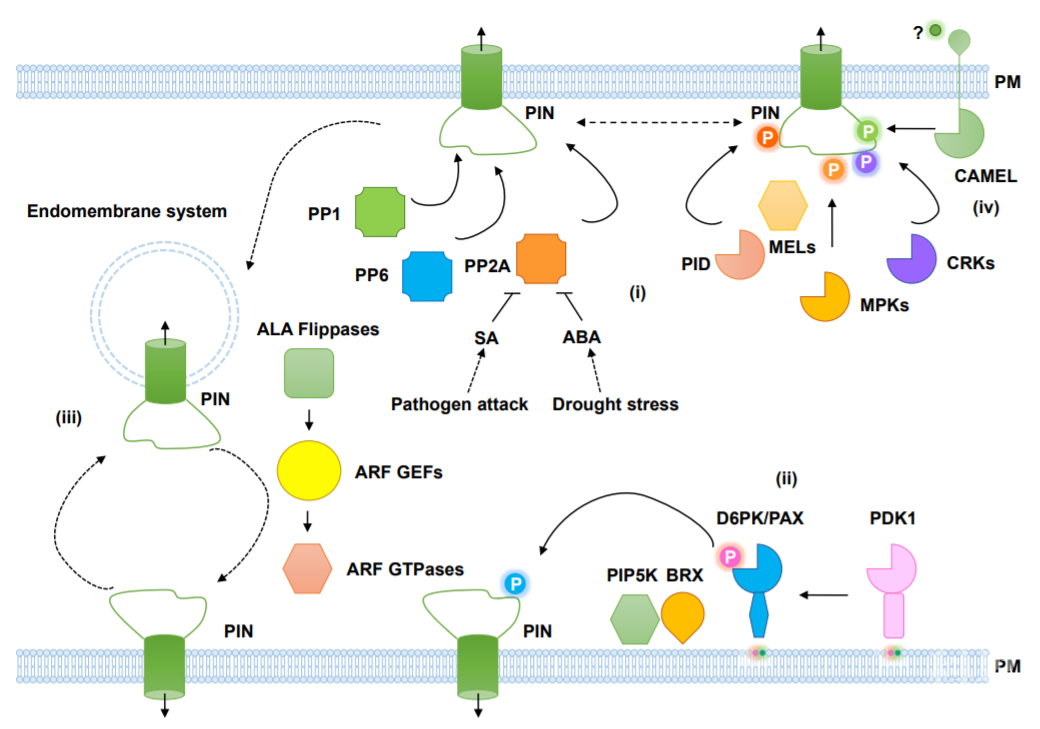
图2 参与PIN调节的蛋白磷酸化过程
2.6 PIN蛋白的去磷酸化
与蛋白激酶相反,蛋白磷酸酶通过水解共价连接的磷酸基团使PIN蛋白去磷酸化。PIN去磷酸蛋白,包括蛋白磷酸酶2A(PP2A),PP1和PP6等。PP2A通过使PIN蛋白去磷酸化来拮抗PID,二者共同决定了PIN蛋白的极性。近期研究表明,PP2A的C亚基能够与ABA受体相结合,PP2A的A亚基直接与SA结合,调控生长素的运输和根的发育[15,16]。
3. 生长素信号转导过程的蛋白磷酸化
3.1 TIR/AFBs途径中的蛋白磷酸化
TIR1/AFB生长素受体介导植物对于生长素的多种响应。在植物中,生长素激活TIR1/AFB的E3连接酶受体以降解AUX/IAA,从而释放ARF转录因子来控制下游基因表达。生长素促进芽中的细胞生长,抑制根中细胞生长。与经典生长理论相一致,生长素通过TIR1/AFB-AUX/IAA途径迅速诱导SMALL AUXIN UP RNA蛋白的表达,从而抑制PP2C-D。导致质膜H+-ATP酶活性增加,细胞外质子浓度升高,最终刺激芽中的细胞伸长(图3)。
3.2 TMK1介导的生长素信号通路和MPK通路
TMK1是拟南芥中最早鉴定的RLK之一。已经提出TMK1家族成员作为质膜受体或受体复合物的一部分,感知细胞外生长素,然后将信号翻译成各种磷酸化事件。在生长素激活后,TMK1激酶域被不同蛋白酶切割。裂解的激酶结构域通过与IAA32和IAA34相互作用并使其磷酸化来调节转录反应[17]。此外,生长素-TMK途径激活MPK途径以控制侧根模式。这些研究确立了TMK和MPK在生长素介导的发育过程中的关键作用[18](图3)。
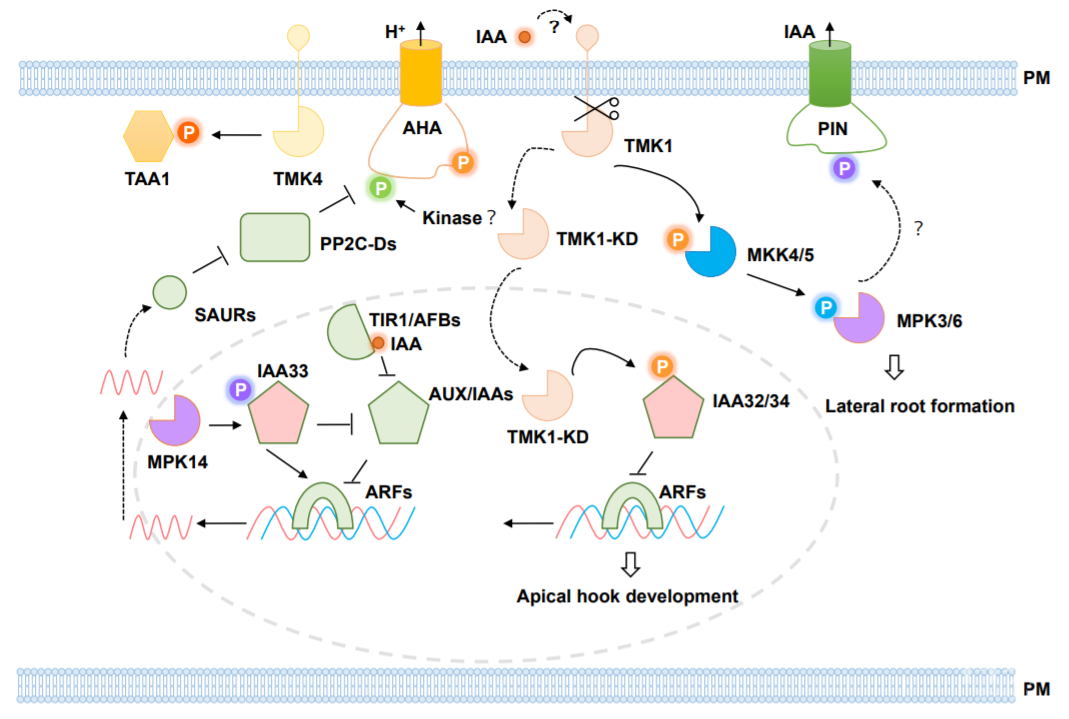
图3 生长素信号过程中的蛋白磷酸化
意义与展望
随着几十年来生长素研究的发展,现在普遍认为生长素响应的时空转变受到当地生长素代谢、转运以及激素识别的严格控制。不同的生长素浓度会引起不同的反应,这不能完全由传统的TIR1/AFB转录途径来解释。因此,转录调控以及翻译后的过程都是生长素调控领域的关注核心。当涉及蛋白质磷酸化时,在不同发育背景下的激酶/磷酸酶-底物相互作用需要进一步阐述。此外,有必要借助先进的质谱方法研究不同遗传背景下的磷酸化蛋白质组,揭示未知的生长素信号网络的作用模式。
参考文献
1. Wang, Q., Qin, G., Cao, M., Chen, R., He, Y., Yang, L., Zeng, Z., Yu, Y., Gu, Y.,Xing, W., et al. (2020). A phosphorylation-based switch controls TAA1-mediatedauxin biosynthesis in plants. Nat. Commun. 11:679.
2. Willems, P.,Horne, A., van Parys, T., Goormachtig, S., van Breusegem, F., and Gevaert, K.(2019). The Plant PTM Viewer, a central resource for exploring plant protein modifications. Plant J. 99:752–762.
3. Friml, J., Yang,X., Michniewicz, M., Weijers, D., Quint, A., Tietz, O., Benjamins, R., Ouwerkerk,P.B.F., Ljung, K., Sandberg, G., et al. (2004). A PINOID-dependent binary switch in apical-basal PIN polar targeting directs auxin efflux. Science 306:862–865.
4. Dhonukshe, P.,Huang, F., Galvan-Ampudia, C.S., Mahonen, A.P., Kleine-Vehn, J., Xu, J., Quint,A., Prasad, K., Friml, J., Scheres, B., et al. (2010). Plasma membrane-bound AGC3 kinases phosphorylate PIN auxin carriers at TPRXS(N/S) motifs to directapical PIN recycling. Development 137:3245–3255
5. Huang, F., Zago,M.K., Abas, L., van Marion, A., Galva, C.S., and Offringa, R. (2010).Phosphorylation of conserved PIN motifs directs Arabidopsis PIN1 polarity and auxin transport. Plant Cell 22:1129– 1142.
6. Zhang, J.,Nodzynski, T., Pencik, A., Rolcik, J., and Friml, J. (2010). PIN phosphorylation is sufficient to mediate PIN polarity and direct auxin transport. Proc. Natl. Acad. Sci. U S A 107:918–922.
7. Zourelidou, M.,Absmanner, B., Weller, B., Barbosa, I.C.R., Willige, B.C., Fastner, A., Streit,V., Port, S.A., Colcombet, J., de la Fuente van Bentem, S., et al. (2014).Auxin efflux by PIN-FORMED proteins is activated by two different protein kinases, D6 PROTEIN KINASE and PINOID. Elife 3:e02860.
8. Weller, B.,Zourelidou, M., Frank, L., Barbosa, I.C.R., Fastner, A., Richter, S., Jurgens,G., Hammes, U.Z., and Schwechheimer, C. € (2017). Dynamic PIN-FORMED auxin efflux carrier phosphorylation at the plasma membrane controls auxin efflux-dependent growth. Proc. Natl. Acad. Sci. U S A 114:E887–E896.
9. Marhava, P.,Aliaga Fandino, A.C., Koh, S.W.H., Jelı´nkova´, A., Kolb, M., Janacek, D.P.,Breda, A.S., Cattaneo, P., Hammes, U.Z., Petra´ sek, J., et al. (2020). Plasmamembrane domain patterning and self-reinforcing polarity in Arabidopsis. Dev.Cell 52:223–235.e5
10. Christie, J.M.,Yang, H., Richter, G.L., Sullivan, S., Thomson, C.E., Lin, J., Titapiwatanakun,B., Ennis, M., Kaiserli, E., Lee, O.R., et al. (2011). phot1 inhibition of ABCB19 primes lateral auxin fluxes in the shoot apex required for phototropism.PLoS Biol. 9:e1001076
11. Suetsugu, N.,Takemiya, A., Kong, S.-G., Higa, T., Komatsu, A., Shimazaki, K., Kohchi, T.,and Wada, M. (2016). RPT2/NCH1 subfamily of NPH3-like proteins is essential for the chloroplast accumulation response in land plants. Proc. Natl. Acad. Sci. US A 113:10424–10429
12. Tan, S., Zhang,X., Kong, W., Yang, X.-L., Molna´r, G., Vondra´ kova´ Z., Filepova´ 4, R.,Petra´ sek, J., Friml, J., and Xue, H.-W. (2020). The lipid code-dependent phosphoswitch PDK1–D6PK activates PIN mediated auxin efflux in Arabidopsis. Nat.Plants 6:556–569.
13. Baba, A.I.,Andra´ si, N., Valkai, I., Gorcsa, T., Koczka, L., Darula, Z., Medzihradszky,K.F., Szabados, L., Fehe´r, A., Rigo´, G., et al. (2019). AtCRK5 proteinkinase exhibits a regulatory role in hypocotyl hook development during skoto morphogenesis. Int. J. Mol. Sci. 20:3432.
14. Baba, A.I., Valkai, I., Labhane, N.M., Koczka,L., Andra´ si, N., Klement, E´., Darula, Z., Medzihradszky, K.F., Szabados, L.,Fehe´r, A., et al. (2019). CRK5 protein kinase contributes to the progression of embryogenesis of Arabidopsis thaliana. Int. J. Mol. Sci. 20:6120.
15. Li, Y., Wang,Y., Tan, S., Li, Z., Yuan, Z., Glanc, M., Domjan, D., Wang, K., Xuan, W., Guo,Y., et al. (2020). Root growth adaptation is mediated by PYLs ABA receptor-PP2A protein phosphatase complex. Adv. Sci. 7:1901455
16. Tan, S., Abas,M., Verstraeten, I., Glanc, M., Molna´r, G., Hajny´, J., Lasa´ k, P., Petrı´k,I., Russinova, E., Petra´ sek, J., et al. (2020). Salicylic acid targets protein phosphatase 2A to attenuate growth in plants. Curr. Biol. 30:381–395.e8
17. Cao, M., Chen,R., Li, P., Yu, Y., Zheng, R., Ge, D., Zheng, W., Wang, X., Gu, Y., Gelova´,Z., et al. (2019). TMK1-mediated auxin signalling regulates differential growth of the apical hook. Nature 568:240–243.
18. Huang,R., Zheng, R., He, J., Zhou, Z., Wang, J., Xiong, Y., and Xu, T. (2019).Noncanonical auxin signaling regulates cell division pattern during lateral root development. Proc. Natl. Acad. Sci. U S A 116:21285–21290.
来源:frontiersin 植物科学最前沿
原文链接:http://mp.weixin.qq.com/s?__biz=MzIyOTY2NDYyNQ==&mid=2247507110&idx=4&sn=101e236483b34514b8087238ded673bc
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


