来源:BioArt
有丝分裂(mitosis)是动物细胞的基本分裂形式,该过程受到严格调控,以保证产生正常子代细胞,进而维持细胞的更新换代和人体的生长发育。当有丝分裂发生异常时,通常会激活细胞纺锤体组装检查点(spindle assemble checkpoint, SAC)【1】,延缓有丝分裂以修复异常。然而,一些细胞会“逃过”该监视过程分裂产生非整倍体子代细胞(aneuploidy),导致基因组失稳,促进细胞转化和肿瘤进展。及时发现并清除这些异常细胞对于维持细胞基因组稳定和组织稳态至关重要。
近日,军事科学院军事医学研究院孙强研究员团队、解放军总医院王小宁教授和首都医科大学黄红艳教授合作在Cell Death & Differentiation上发表了题为p53-dependent Elimination of Aneuploid Mitotic Offspring by Entosis的文章【2】。首次报道了一种全新的细胞有丝分裂监测(mitotic surveillance)机制——细胞套亡(Entosis),该机制通过激活p53信号通路选择性的促进非整倍体子代细胞钻入相邻细胞形成cell-in-cell结构,进而被清除以维持上皮细胞基因组稳定性。

研究人员利用细胞动态成像技术在人未转化上皮细胞MCF-10A中观察到,部分细胞有丝分裂过程中会出现短暂的分裂阻滞,随后逃逸阻滞成功分裂,同时其产生的子代细胞会钻入相邻细胞中,形成cell-in-cell结构,进而死亡。

图a展示了细胞分裂后发生entosis(Entotic Division)和细胞正常分裂(Normal Divsion)两种过程。黄色箭头指示内化细胞,蓝色箭头指示正常贴壁细胞,黑色箭头指示外部细胞。图b展示了形成CIC结构的内部细胞逐步死亡的过程。黄色箭头指示内部细胞。
进一步研究显示:有丝分裂阻滞导致的M期延长一方面上调细胞内的RhoA活性,另一方面导致DNA损伤的累积,激活下游的p53信号通路,通过上调小G蛋白RND3促进RhoA活性在细胞内的极化分布,推动细胞内化形成cell-in-cell结构。进一步利用动态显微成像(time lapse microscopy)结合荧光原位杂交(FISH)技术对内化细胞染色体数目分析显示,内化细胞为非整倍体的子代细胞,抑制cell-in-cell结构形成介导的细胞套亡(Entosis)导致非整倍体细胞的显著累积。
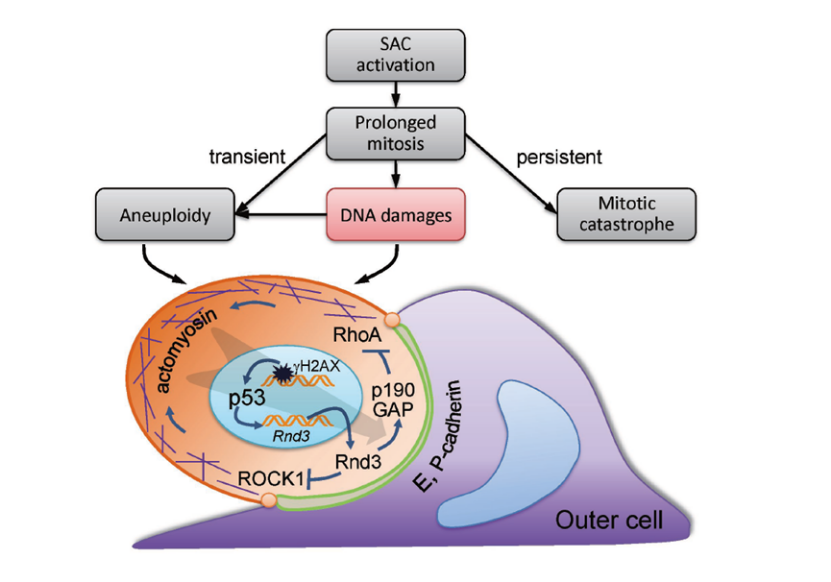
细胞套亡(entosis)介导p53依赖的有丝分裂监视机制工作模型
本研究首次阐述了细胞套亡(Entosis)的生理功能,发现了细胞周期调控之外的异常细胞清除新机制,同时揭示了p53基因在细胞水平维持上皮稳态和抑制肿瘤发生的新通路;一方面丰富了现有的有丝分裂监控机制(mitotic surveillance)的内涵;另一方面拓展了细胞套亡(Entosis)作为一种细胞死亡机制参与重要生物学过程的外延;是细胞分裂和细胞死亡领域的又一概念性突破。
该研究是军事医学研究院孙强研究员及其合作团队今年在cell-in-cell领域研究的又一重要进展。该团队今年5月在Front Cell Dev Biol杂志报道了首个负性调控entotic cell-in-cell结构形成粘附蛋白家族分子——PCDH7【3】;8月份在Cell Reports杂志报道了调控entotic cell-in-cell结构形成的第三个核心元件——着力环(详见BioArt报道:孙强/马骊/黄红艳团队合作发现驱动Entotic cell-in-cell结构形成的第三个关键结构元件-着力环)【4】;10月份在Signal Transduct Target Ther杂志报道迄今为止国际上首个多中心、样本量最大的cell-in-cell分型分析研究,发现肿瘤细胞内化免疫细胞形成的异质性cell-in-cell结构是人胰腺导管癌不良预后相关的独立预测因素,尤其是对年轻的女性病人预测效力最强,远强于传统的组织学分级和TNM分期(详见BioArt报道:黄红艳/孙强/王小宁/崔培林团队发现异质性cell-in-cell结构作为一种新型功能病理指标预测胰腺导管腺癌的不良预后)【5】。以上研究成果推动了cell-in-cell研究在生物学功能、形成机制以及辅助肿瘤的临床诊疗等方面进展。
该论文第一作者为军事科学院军事医学研究院与华南理工大学联合培养硕士研究生梁剑青(目前为复旦大学在读博士生)、军事科学院军事医学研究院助理研究员牛祖彪、首都医科大学北京世纪坛医院博士研究生张波和军事科学院军事医学研究院硕士研究生于晓晨。军事科学院军事医学研究院孙强研究员、解放军总医院王小宁教授、首都医科大学北京世纪坛医院黄红艳教授为该论文的共同通讯作者。
参考文献
1. Musacchio, A., The Molecular Biology of Spindle Assembly Checkpoint Signaling Dynamics. Curr Biol 25, R1002-18 (2015)
2. Liang, J., et al., p53-dependent elimination of aneuploid mitotic offspring by entosis. Cell Death Differ (2020)
3. Wang, C., et al., PCDH7 Inhibits the Formation of Homotypic Cell-in-Cell Structure. Front Cell Dev Biol 8, 1-12 (2020)
4. Wang, M., et al., Mechanical Ring Interfaces between Adherens Junction and Contractile Actomyosin to Coordinate Entotic Cell-in-Cell Formation. Cell Rep 32, 108071 (2020)
5. Huang, H., et al., Identification and validation of heterotypic cell-in-cell structure as an adverse prognostic predictor for young patients of resectable pancreatic ductal adenocarcinoma. Signal Transduct Target Ther 5, 246-248 (2020)
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652507381&idx=8&sn=a13ee8c727bf4c1dd0fbd87306ae4339&chksm=84e19f41b396165776207914f7b93220d6d9b1b9419d422a104dd57a235dcf5e2a705615e991#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn