来源:BioArt
撰文 | 敏君
责编 | 兮
1928年,英国生物学家弗莱明发现了世界上第一种抗生素——青霉素,在第二次世界大战中挽救了数以万计的士兵的生命。在此后的几十年中,越来越多的天然和合成型抗生素被开发和利用,成为人类对抗细菌感染的有力武器。然而,由于抗生素滥用等原因导致的抗生素耐药性已成为目前全球公共健康和食品安全的最大威胁之一【1】。世界卫生组织公布的数据显示,以鲍曼尼氏杆菌、铜绿假单胞菌和肠杆菌等为代表的ESKAPE(即Enterococcus faecium, Staphylococcus aureus,Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa和Enterobacter spp)革兰氏阴性病原菌对碳青霉烯或第三代头孢菌素的耐药性更是其中的突出问题【2】。某些革兰氏阴性菌已产生针对最新型抗生素——粘菌素的抗药性,因此,开发针对革兰氏阴性菌的新型抗生素已刻不容缓【3】。
2019年10月24日,瑞士Polyphor生物制药公司首席科学家Daniel Obrecht博士带领的团队在Nature杂志发表了题为“Chimeric peptidomimetic antibiotics against Gram-negative bacteria”的长文,合成了一类由β-发卡肽大环化合物与粘菌素和多粘菌素家族天然产物中大环化合物连接而成的嵌合型抗生素,并证明其对多重耐药病原体具有高效的杀灭活性,且能在体内和体外状态下有效对抗粘菌素耐药性。

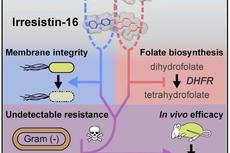
Murepavadin是一种能作用于革兰氏阴性菌外膜蛋白(OMPs)LptD的新型大环β-发卡形拟肽抗生素【4】。作者首先针对ESKAPE革兰氏阴性病原菌进行了Murepavadin有关的环状多肽筛选,发现了一些特异性作用于包括粘菌素耐药菌在内的革兰氏阴性菌的肽段,但某些多肽在人血清中抗菌能力较弱,且具有红细胞膜溶解性。为优化其抗菌活性,作者合成了一系列嵌合分子,以将筛选到的拟肽类抗生素上的β-发卡结构连接到多粘菌素和粘菌素类抗生素的肽大环上。进一步验证发现其中多种嵌合拟肽作用于大肠杆菌会导致其内外膜被穿透,并对膜结构造成实质性损坏,具有良好的抗菌活性,且在哺乳动物细胞和小鼠模型中药物毒性较小。
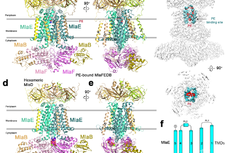
随后,作者进一步研究了嵌合肽抗生素的抗菌机制,发现该类抗生素能结合细菌细胞膜上的脂多糖和一种构成β-桶形折叠复合物(β-barrel folding complex, BAM)的OMP分子BamA。作者推测,嵌合多肽与BamA结合后下游抗菌活性的产生可能存在两种机制,其一是抑制了BAM复合物的折叠酶活性,导致OMPs折叠不正确,当OMPs错误地定位于内膜时,可能会导致细胞透化和死亡。其二是嵌合多肽与BamA的结合为外膜提供了一个额外的结合位点,增强了多粘菌素大环介导的透化作用,并使这些抗生素避免了脂多糖修饰导致的耐药作用。
本研究合成了针对革兰氏阴性菌的新型嵌合多肽抗生素,并证明其具有很好的抗菌活性,后续研究中作者将继续探明嵌合多肽的下游抗菌机制。作者在文中透露,该研究发现的候选嵌合多肽目前正在进行临床前毒理学研究,顺利的话会继续向临床实验推进。本研究将为解决由革兰氏阴性病菌引起的致命感染问题提供潜在的治疗方案,并为缓解目前的抗生素耐药性问题提供新的可能。
原文链接
https://doi.org/10.1038/s41586-019-1665-6
制版人:小娴子
参考文献
1. O’Neill, J. Project Syndicate– A Call to Antimicrobial Arms https://www.project-syndicate.org/commentary/antibiotics-resistance-economic-costs-by-jim-o-neill-2015-02(2015).
2. WHO. Global Priority Listof Antibiotic-resistant Bacteria to Guide Research, Discovery, and Developmentof New Antibiotics (World Health Organization, Geneva, 2017).
3. Paterson, D. L. &Harris, P. N. A. Colistin resistance: a major breach in our last line ofdefence. Lancet Infect. Dis. 16, 132–133 (2016).
4. Srinivas, N. et al.Peptidomimetic antibiotics target outer-membrane biogenesis in Pseudomonasaeruginosa. Science 327, 1010–1013 (2010).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652476919&idx=5&sn=e795f626d0c83d8e37dd0fb7365ee07b&chksm=84e20643b3958f5557f040eefe132d69942b2e97125dbb8129aab93b572335f5ecc791e8d28c&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn