来源:BioArt
原标题:Nat Comm丨提供新外排泵药物靶点——王钊团队揭示革兰氏阴性菌多药外排泵AcrAB-TolC在活细胞内的组装机制
随着抗生素的广泛使用,细菌耐药性特别是革兰氏阴性菌的耐药性已成为困扰世界各国的一大难题。在全球范围内,每年约有70万人死于各种耐药菌感染。细菌耐药的机制复杂多样,通过外排泵将药物主动外排是其产生多药耐药性的主要原因[1-2],因此外排泵被认为是开发新抗生素的理想靶标。在革兰氏阴性菌中,有些外排泵是由外膜蛋白、膜间质蛋白和内膜蛋白组成的三联体复合物,它们横跨细胞内外膜和膜间质,可有效外排多种毒性分子[3]。然而,这类外排泵在细胞原位的结构和组装机制尚不清楚。
为了揭示三联外排泵的原位结构和组装机制,美国贝勒医学院王钊研究组从2018年4月开始着手对大肠杆菌多药外排泵AcrAB-TolC的原位结构进行研究,分别从样品制备、数据收集和计算等方面进行了不断的摸索和改进。2019年 6月14日,该研究组在Nature Communications在线发表了题为In situstructure and assembly of the multidrug efflux pump AcrAB-TolC 的论文,首次报道了多药外排泵AcrAB-TolC在活细胞内的原位结构。

在本项研究中,研究人员在大肠杆菌BL21(DE3)细胞中过表达了AcrAB-TolC外排泵,接着采用嘌呤霉素(puromycin)处理细胞以促进AcrAB-TolC组装[4],最后采用冷冻断层成像和子断层平均法进行分析。研究人员首先发现,puromycin 处理之后,AcrAB-TolC外排泵长33nm,TolC: AcrA: AcrB为3:6:3,和体外的冷冻电镜结构一致[5-6]。意想不到的是,尽管采用了高浓度puromycin处理了细胞,AcrAB-TolC外排泵处于“关闭”状态,表明抗生素外排是一个瞬时的过程。当采用AcrB抑制剂(MBX3132)处理细胞之后,AcrAB-TolC外排泵处于“打开”状态,且长度比关闭状态减少了1 nm,表明沿着长轴收缩是其运输过程中的一部分(图一)。
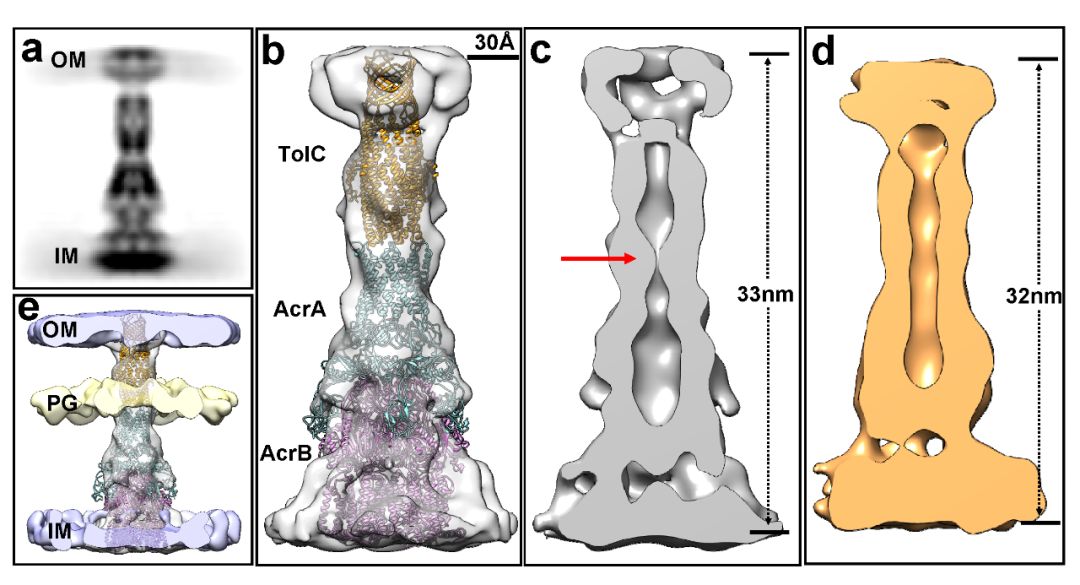
图一:完全组装的AcrAB-TolC外排泵的原位结构
除了解析组装完全的AcrAB-TolC外排泵两种不同的状态之外,研究者还通过分类的方法发现了外排泵组装中间体AcrAB亚复合体,其中AcrA和AcrB的比例和组装完全的外排泵一样(图二)。更为有趣的是,他们观察到AcrA通过其α-发卡结构域和肽聚糖层(PGlayer)相互作用,并通过体内化学交联的方法对这一发现进行了验证。该结果暗示了PG可能在AcrAB-TolC外排泵组装过程中发挥作用。
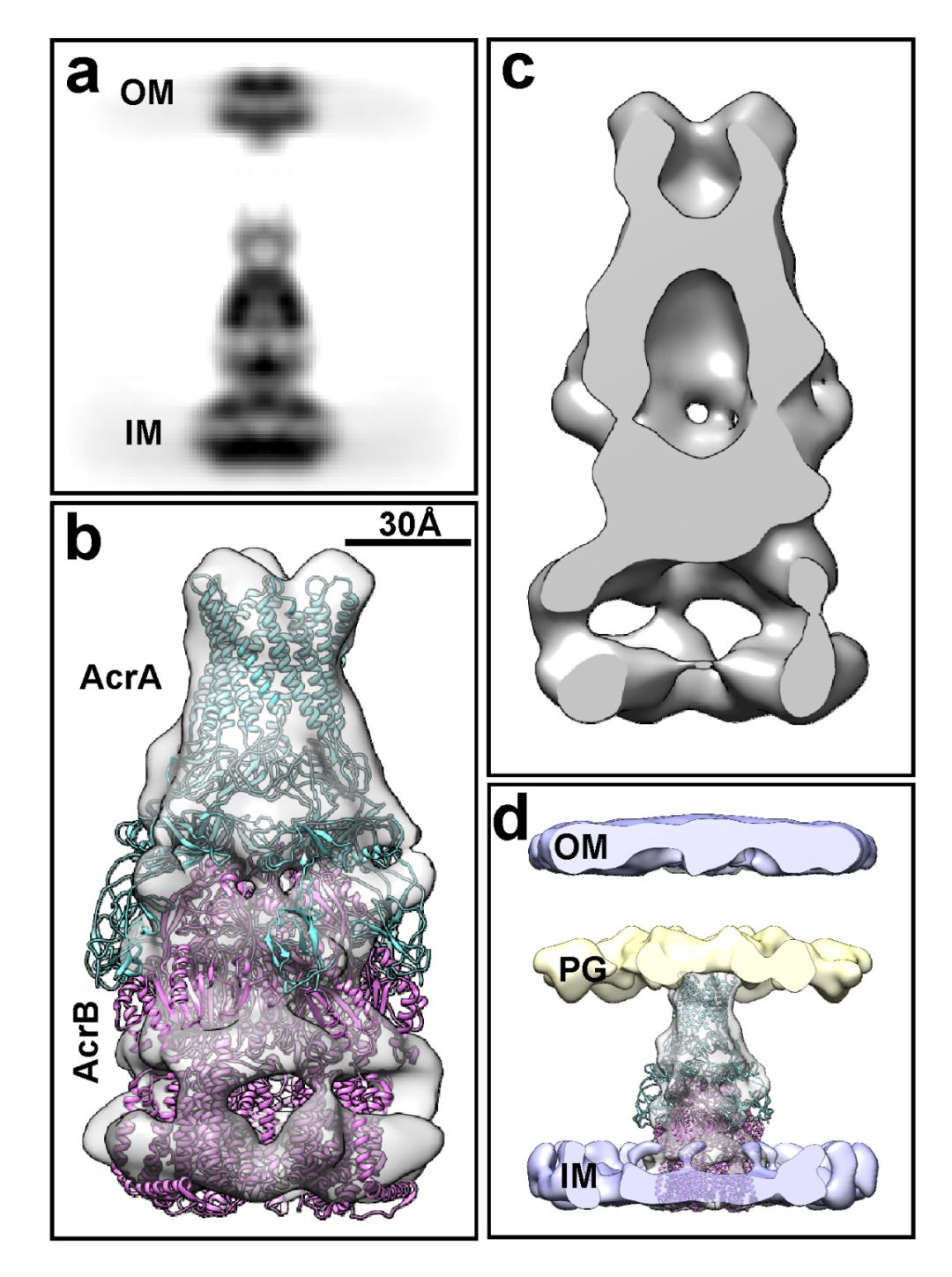
图二:AcrAB亚复合体的原位结构
综上所述,本研究表明AcrAB-TolC在体内按照如下顺序组装:首先AcrA和AcrB形成AcrAB亚复合体,AcrA的α-发卡结构域和PG的接触帮助维持AcrAB亚复合体的稳定性,直至其招募到TolC。在抗生素存在的情况下,AcrAB亚复合体发生构象改变招募TolC,此时外排泵处于“关闭”状态,接下来,伴随着收缩,外排泵打开,将抗生素泵出细胞外(图三)。上述结果提供了新的外排泵药物靶点,干扰AcrA和AcrB的相互作用,或者干扰AcrA和PG的相互作用可能会阻断组装过程,从而破坏AcrAB-TolC的功能。
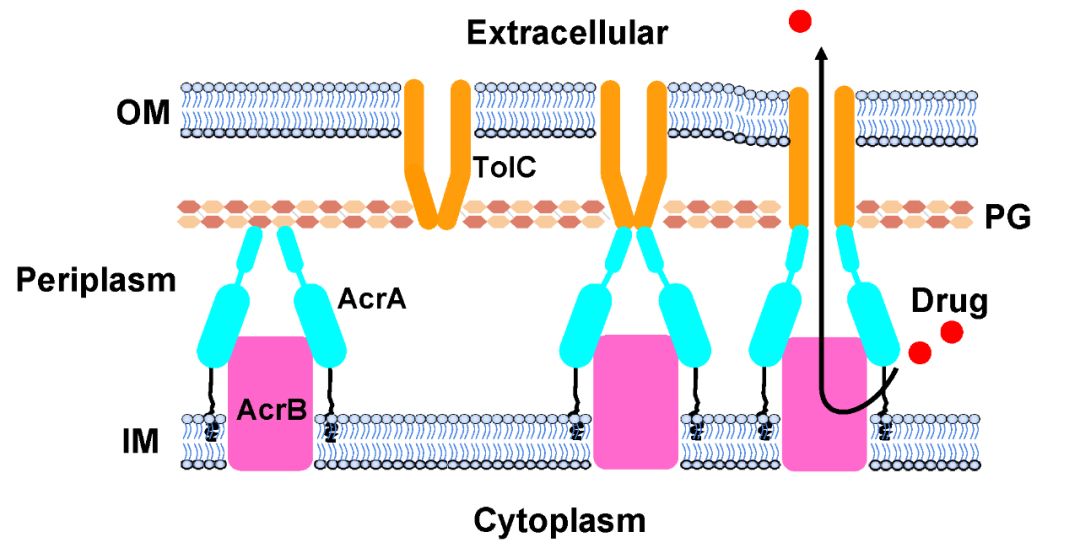
图三: AcrAB-TolC外排泵在体内的组装和功能机制示意图
原文链接:
https://www.nature.com/articles/s41467-019-10512-6
制版人:小娴子
参考文献
1. K.Poole, Efflux-mediated antimicrobial resistance. J. Antimicrob. Chemother. 56,20–51(2005).
2.X.-Z. Li, P. Plésiat, H. Nikaido, The challenge of efflux-mediated antibioticresistance in Gram-negativebacteria. Clin. Microbiol. Rev. 28, 337–418 (2015).
3. D.Du, H. W. van Veen, S. Murakami, K. M. Pos, B. F. Luisi, Structure, mechanismand cooperation of bacterial multidrug transporters. Curr.Opin. Struct. Biol. 33, 76–91 (2015).
4. E. B. Tikhonova, H. I. Zgurskaya, AcrA, AcrB, andTolC of Escherichia coli Form a Stable Intermembrane MultidrugEfflux Complex. J. Biol. Chem. 279, 32116–24 (2004).
5. D. Du etal., Structure of the AcrAB-TolC multidrug efflux pump. Nature. 509,512–5(2014).
6. Z.Wang et al., An allosteric transport mechanism for the AcrAB-TolCmultidrug efflux pump. Elife.6 (2017), doi:10.7554/eLife.24905.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652471788&idx=6&sn=dee46befb51aacd6d41f1eb51555d930&chksm=84e21258b3959b4ecca9691cd7b7f2e906a156aeb17555b198812cd542e633380311c872db2f&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn