来源:BioArt
抗逆转录病毒治疗(antiretroviral therapy,ART)可以有效抑制HIV的复制,缓解病程进展,但是潜伏性感染细胞的存在是治疗HIV的主要障碍。潜伏性感染细胞数量虽然少,但是含有整合的HIV病毒前体,构成HIV潜伏池。而且其通常不表达病毒蛋白,免疫系统不能识别而实现免疫逃逸【1】。潜伏池越大,免疫系统控制病毒就越难,ART一旦中断病毒复发越快【2】。几种抗逆转录病毒药物的联用能够有效控制HIV感染,抑制AIDS的发展,但HIV阳性的病人需要终身服药,并且ART药物具有一定的副作用。
“激活和击杀(shock and kill)”是减少潜伏池的一个主要方法【3】,即潜伏性细胞暴露于一个或多个潜伏逆转剂(latency reversing agents,LRAs),诱导病毒蛋白如Env表达。Env将插入到细胞表面,被病毒诱导的细胞病变导致细胞杀伤而清除,或者被免疫细胞识别为异物而清除。但是,只有强效的LRAs能够触发病毒诱导的细胞病变导致细胞杀伤,但强效的LRAs具有毒副作用,包括诱发细胞因子风暴,在临床上使用相当有限。虽然需要寻找更加稳定、非毒性的“shock”来激活潜伏性细胞,但“激活和击杀”策略的成功实施依赖于高效率地击杀激活的细胞。HIV感染常常导致杀伤性T细胞(CTL)丧失效应功能和增殖功能,进入耗竭状态【4】。此外,CTL抵抗性病毒株被报道。所以,如果想要提高HIV感染者的细胞免疫,对HIV潜伏池进行清除,则必须克服这两个障碍。
2019年10月25日,来自美国加州大学旧金山分校的Warner C. Greene团队在Cell杂志上发表文章Attacking Latent HIV with convertible CAR-T Cells, a Highly Adaptable Killing Platform,报道了一种新型可转换型CAR-T细胞平台,即将CTL与一系列广谱的抗HIV抗体进行结合,并证明了可转换型CAR-T平台只有与抗HIV抗体结合时,才能够高效地特异性地击杀血液、扁桃体和脾脏中HIV感染的CD4+ T细胞;接受抗逆转录病毒治疗的HIV感染者的血液中存在可诱导的潜伏池,而可转换型CAR-T细胞能在48小时内击杀其半数以上的潜伏性细胞。可转换型CAR-T细胞具有模块化功能,可以实现多个抗HIV抗体的搭载,大大提高了击杀的广度和控制能力,使其成为攻击潜伏HIV库的有力工具。

为了提高击杀被激活细胞的能力,研究人员将广谱抗HIV抗体(bNAbs)和CAR-T进行整合。配体MIC/ULBP在应激细胞中表达,其受体NKG2D在CTL和NK细胞上表达,系统利用两者天然具有结合的能力实现链接。即对NKG2D的结合口袋进行突变使其惰性化,不能够结合天然的配体;相应地,对MIC配体的α1- α2结构域进行突变,以避免与野生型NKG2D结合。这样就构建了一个独特的、唯一的正交配对系统,突变型NKG2D被格式化成CAR并表达于CD8+ T细胞,突变型α1- α2结构域与HIV bNAbs融合产生具有双特异性的MicAbody。结合实验显示,MicAbody和突变型NKG2D亲和力非常高,达到亚纳摩尔级;而且两者的结合具有特异性。同时MicAbody的Fv结构域与HIV感染细胞表面的HIV-Env蛋白抗原高效结合。为了验证转换型cCAR-T的杀伤效果,研究人员在MicAbody的重链引入两个突变,抑制了MicAbody诱发NK细胞的抗体依赖性细胞杀伤作用,确保MicAbody-cCAR-T的相互作用是杀伤的唯一来源。将B细胞特异的抗CD20单抗-rituximab搭载到cCAR-T上,有效控制肿瘤生长,而且抗肿瘤效果与传统性CAR-T相当,验证了cCAR-T的杀伤功能。
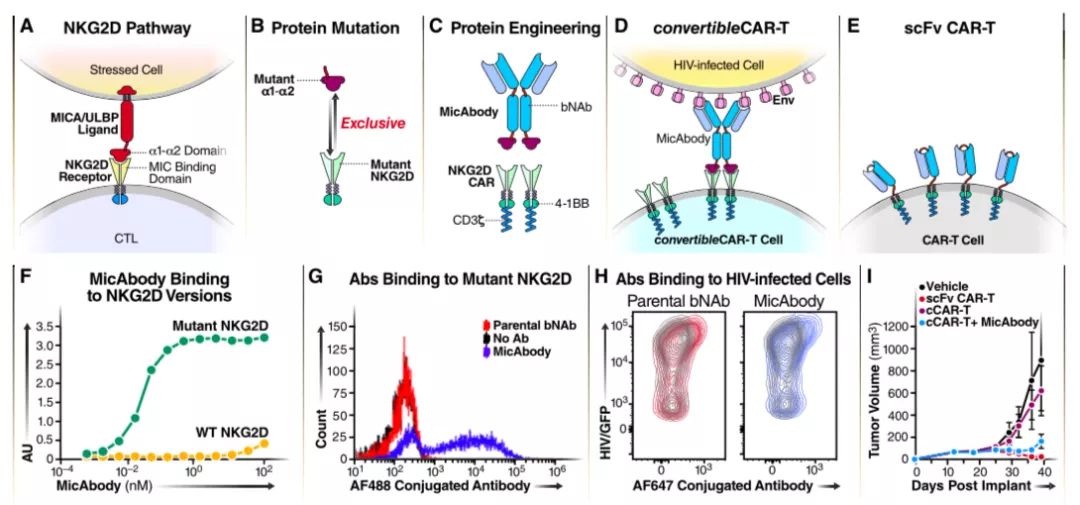
HIV MicAbody和cCAR-T的联用是否能够对HIV感染的原代CD4+ T细胞有效地击杀?研究人员利用HIV-GFP对扁桃体来源的CD4+ T细胞进行感染,然后与cCAR-T细胞进行共培养,检测其杀伤能力。对HIV感染细胞的杀伤效率与效应cCAR-T的数量相关,但过多的效应cCAR-T导致未感染HIV的CD4+ T细胞的活性降低,故效应cCAR-T:靶标细胞的比例在10:1较为合适。未搭载抗体或搭载了anti-CD20、anti-HER2 MicAbody的cCAR-T均对HIV感染细胞没有杀伤功能;只有搭载了HIV特异性MicAbody的cCAR-T具有杀伤功能,而且对未感染HIV的细胞没有影响。cCAR-T是两部分对接,且可调节式系统,其可以搭载不同MicAbody,以扩展靶向细胞的广度。同时使用搭载了anti-CD20和HIV特异性抗体的cCAR-T其对B细胞、HIV感染细胞的杀伤能力与单独使用相当,并没有削弱其杀伤功能。此外,虽然cCAR-T介导的杀伤具有高度特异性,但其效率维持在65%。这可能与感染细胞产生的HIV基因产物的数量有关,与细胞表面的Env蛋白的数量相关。对杀伤进行时间过程分析,发现共培养约10-15小时后,杀伤现象出现,HIV感染细胞的数量开始下降,表明效应细胞和MicAbody的结合、MicAbody和靶标细胞的结合需要一定的时间。
最后,研究人员对cCAR-T是否能够杀伤HIV潜在感染细胞进行测试。从6位接受ART治疗且HIV阳性受试者的血液中分离CD4+ T细胞,使用强效的潜伏逆转剂进行处理后,与cCAR-T、HIV MicAbody共培养。搭载了HIV MicAbody的cCAR-T显著降低HIV病毒滴度,bNAb-cCAR-T系统能够攻击诱导性潜伏池。
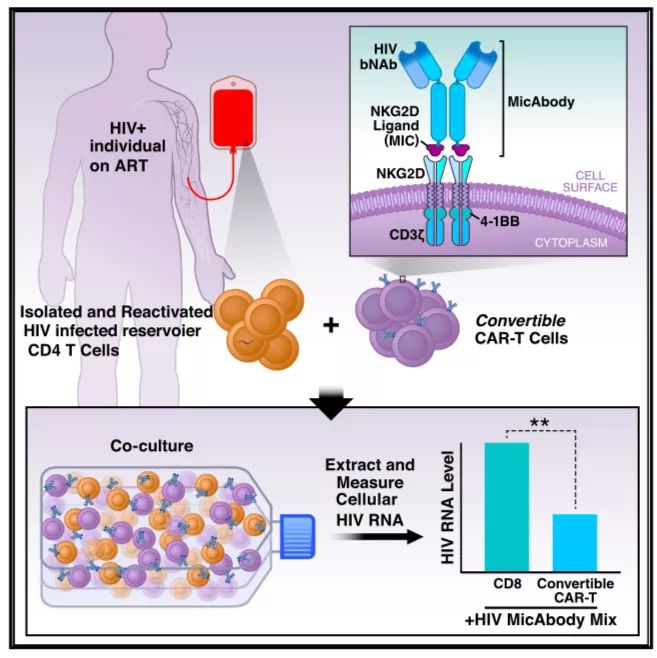
总的来说,研究报道了一种新型的转换型CAR-T平台,利用NKG2D-MIC的配体-受体结合作用,将“抗原识别”功能从CAR分子上分离出来,使用一种或多种双特异性抗体实现抗原的识别过程,并与CAR分子结合,从而实现对靶标细胞的精准击杀。转换型CAR-T平台具有灵活性,大大扩展靶向细胞的广度和控制能力,为治疗HIV提供了新的工具。
原文链接:
https://doi.org/10.1016/j.cell.2019.10.002
参考文献
1. Richman, D.D., Margolis, D.M., Delaney, M., Greene, W.C., Hazuda, D., and Pomerantz, R.J. (2009). The challenge of finding a cure for HIV infection. Science 323, 1304–1307.
2. Li, J.Z., Etemad, B., Ahmed, H., Aga, E., Bosch, R.J., Mellors, J.W., Kuritzkes, D.R., Lederman, M.M., Para, M., and Gandhi, R.T. (2016). The size of the expressed HIV reservoir predicts timing of viral rebound after treatment interruption. AIDS 30, 343–353.
3. Archin, N.M., Liberty, A.L., Kashuba, A.D., Choudhary, S.K., Kuruc, J.D., Crooks, A.M., Parker, D.C., Anderson, E.M., Kearney, M.F., Strain, M.C., et al. (2012). Administration of vorinostat disrupts HIV-1 latency in patients on antiretroviral therapy. Nature 487, 482–485.
4. Cella, M., Presti, R., Vermi, W., Lavender, K., Turnbull, E., Ochsenbauer-Jam- bor, C., Kappes, J.C., Ferrari, G., Kessels, L., Williams, I., et al.; CHAVI Clinical Core B; NIAID Center for HIV/AIDS Vaccine Immunology (2010). Loss of DNAM-1 contributes to CD8+ T-cell exhaustion in chronic HIV-1 infection. Eur. J. Immunol. 40, 949–954.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652476978&idx=1&sn=ef6d3263b69ddce3262c04103accd1c4&chksm=84e20586b3958c90e9061efe35933959630c6a6df4cea7f1ce155df29fd2166704c7c717fd05&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



