来源:高分子科学前沿
癌症作为影响人类健康的重大疾病,因其具有极高的致死率而被广泛研究。临床上针对不同的癌症类别开发了多种药物治疗手段,其中,基于纳米粒子载体的药物传递体系受到广泛关注。
然而,如何实现纳米粒子在肿瘤组织的富集和释药一直是极具挑战的问题。研究发现,肿瘤组织癌细胞表面存在特定的抗原(如,癌胚抗原,CEA),这些抗原的存在有助于同源癌细胞在肿瘤组织处的粘附。
因此,将癌细胞细胞膜包被在纳米粒子表面将有效提高纳米粒子在肿瘤组织处的富集,实现主动靶向给药。
目前,主流的研究大多基于细胞系构建小鼠的异种移植模型,与实际情况中的人来源细胞相差甚远,临床转换存在较大的障碍。
基于此,来自中科院长春应化所的肖海华研究员,武汉大学的刘威教授,孙志军教授和美国NIH中心的陈小元教授合作开发了一种头颈部鳞状细胞癌病人来源的癌细胞(PDTC)细胞膜包被的明胶纳米粒子(PDTC@GNPs),通过分离病人体内肿瘤组织癌细胞,体外分离PDTC的细胞膜成分,与GNPs融合得到PDTC@GNPs,同时,利用同源的PDTC在体外构建小鼠模型,最终,将PDTC@GNPs与顺铂类药物结合得到PDTC@GNPs@Pt,实现了肿瘤的个性化治疗。

图1 实验方案
为了验证不同来源的癌细胞细胞膜具有特异性识别的功能,作者收集了三种不同来源的PDTC(P1DTC,P2DTC,P3DTC),分别构建了三种小鼠模型(P1DX,P2DX,P3DX)和三种不同的纳米粒子(P1DTC@GNPs,P2DTC@GNPs,P3DTC@GNPs)。体内体外实验均表明,不同来源的粒子更倾向于作用于在同源的PDTC内部富集,对同源的小鼠肿瘤具有更好的治疗能力。例如,P1DTC@GNPs能够更好地被P1DTC内吞,在P1DX小鼠肿瘤处实现富集。
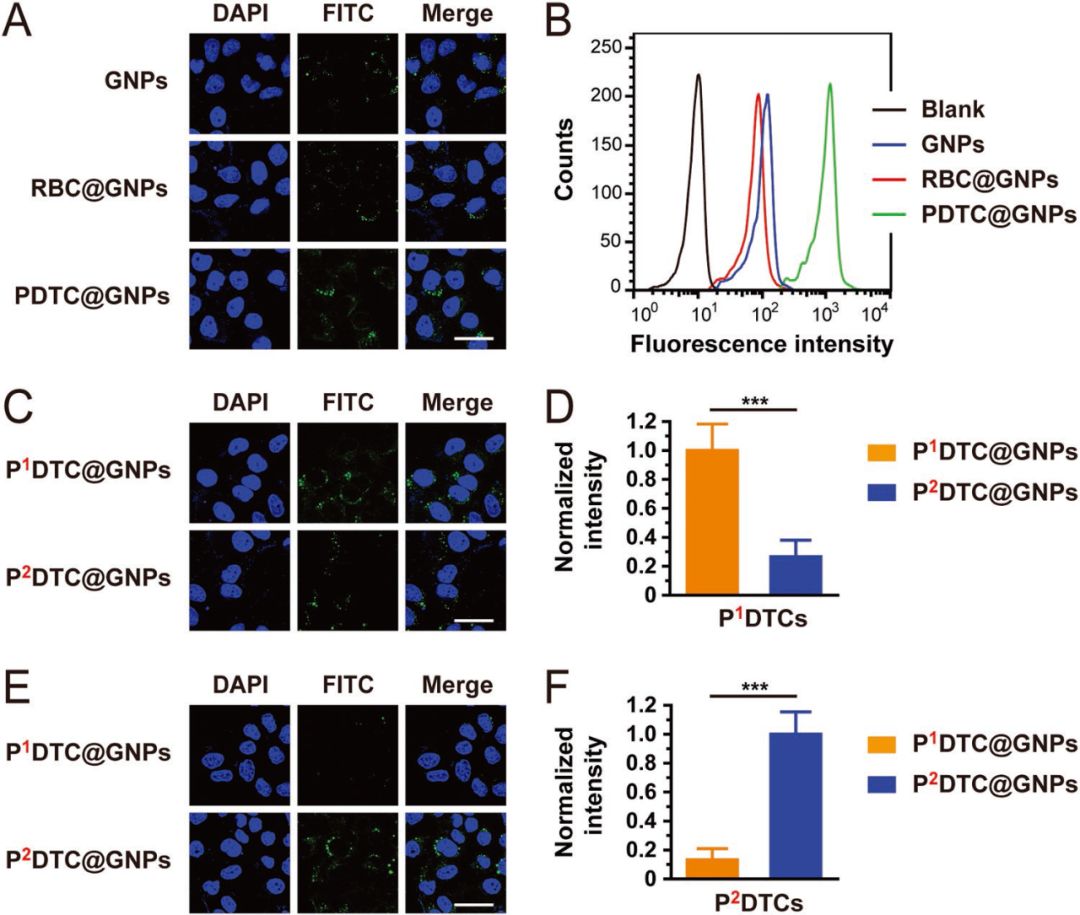
图2 体外实验验证特异性
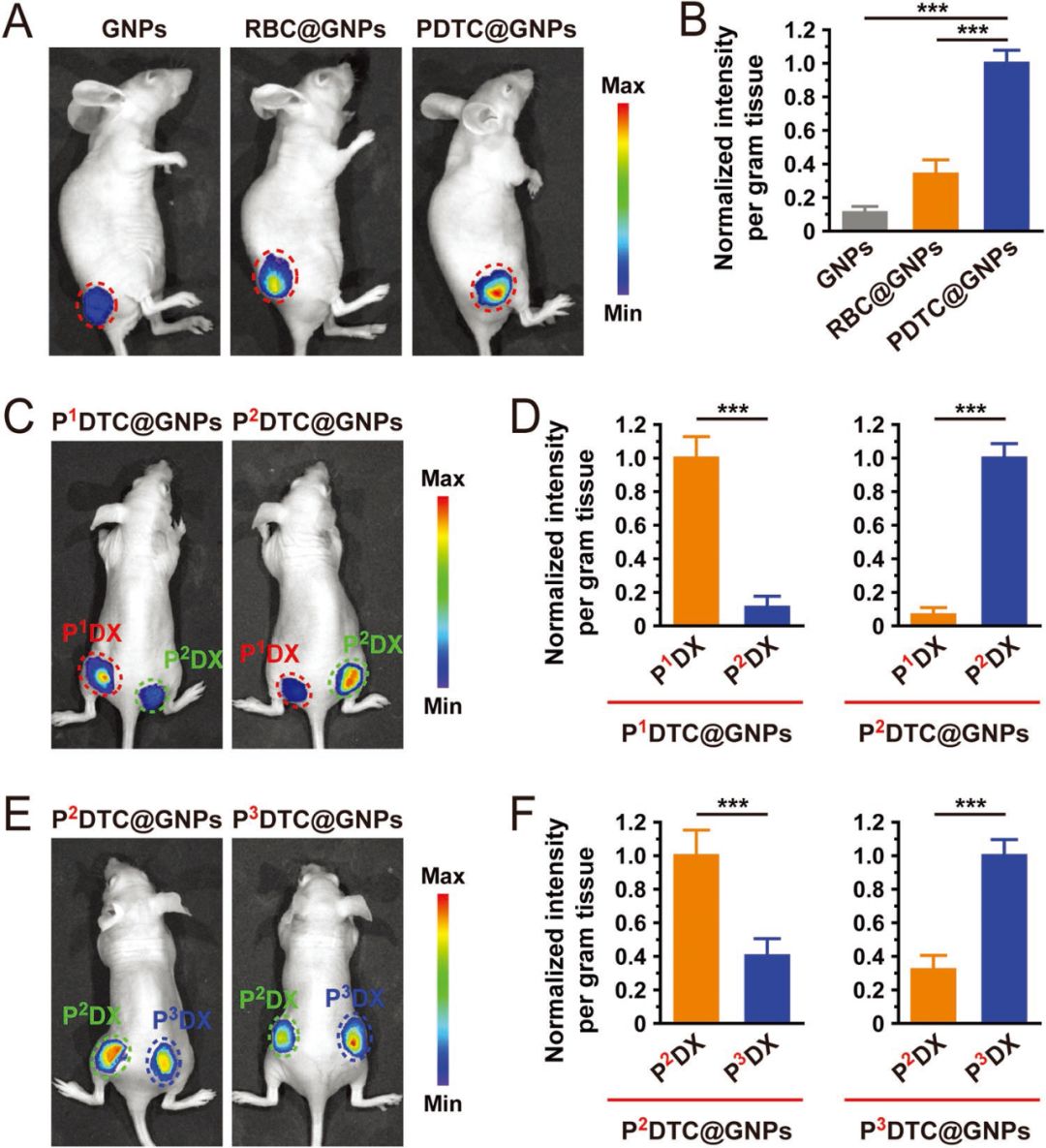
图3 体内实验验证特异性
顺铂类药物作为一种有效的抗肿瘤药物,被广泛应用于抗癌研究。通过负载顺铂类药物可以实现肿瘤组织的清除。作者进一步制备了负载顺铂的纳米粒子(PDTC@GNPs@Pt),体内动物实验表明,这种粒子具有优异的抗肿瘤能力,且具有特异性,能够针对同源性的肿瘤实现优异的治疗效果。
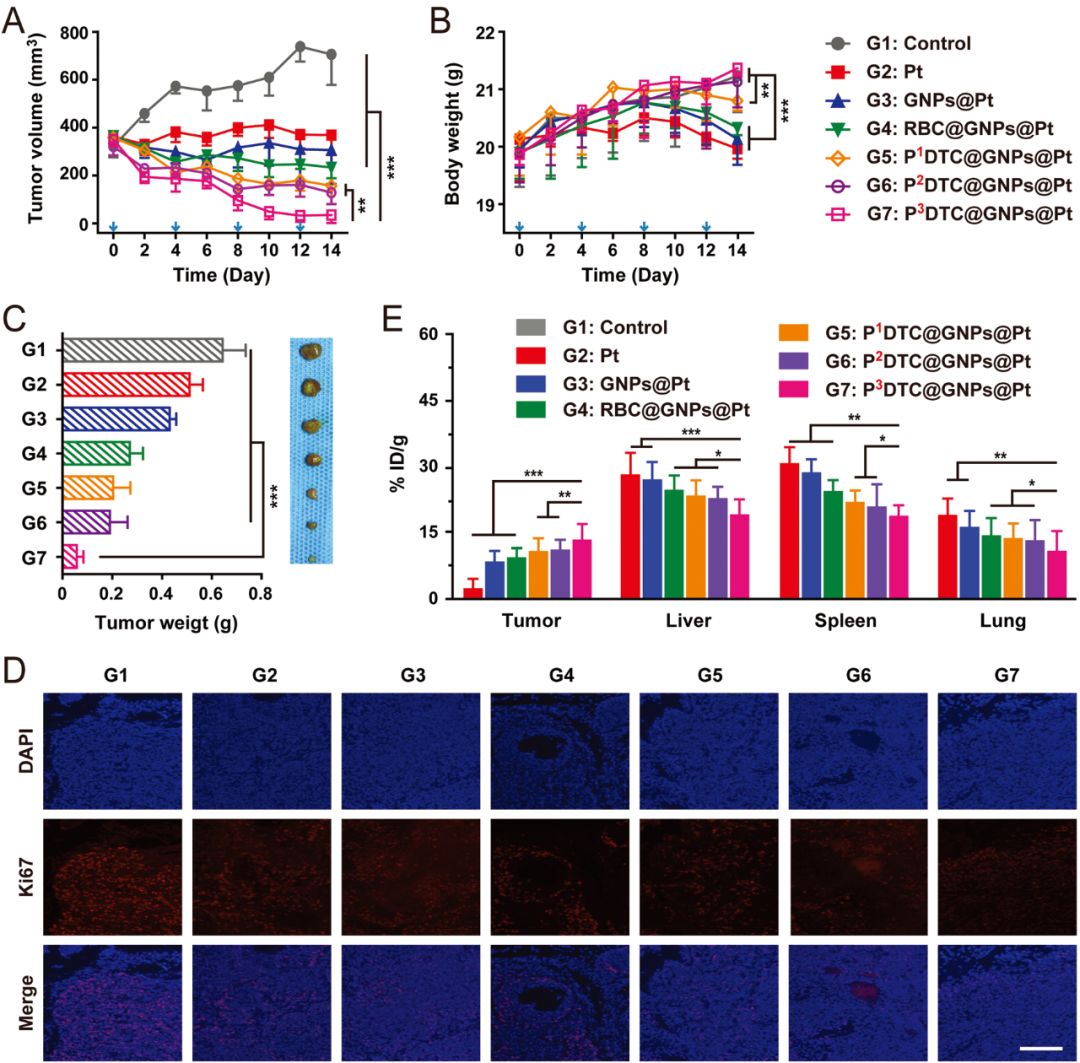
图4 抗肿瘤效果
结论:本论文制备了癌细胞膜包被的纳米粒子,验证了纳米粒子的特异性识别和治疗能力,利用病人体内来源的癌细胞构建了不同来源的小鼠模型,并且验证了同源性载药纳米粒子的抗肿瘤能力,实现了个性化治疗,为临床转化提供了新的思路和可能。
相关工作以“Cancer Cell Membrane-Coated Nanoparticles for Personalized Therapy in Patient-Derived Xenograft Models”为题发表在国际著名期刊《Advanced Functional Materials》上。
全文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201905671
作者:四夕 来源:高分子科学前沿
来源:Polymer-science 高分子科学前沿
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5NjM5NzA5OA==&mid=2651723352&idx=6&sn=9107e0886e76e03c94a511fa2adb0bc2&chksm=8b4a041dbc3d8d0b57b913602e1ef32021cfb85b15fb53f2be3547e331796d7a504306d1cb16&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



