来源:BioArt
原标题:Cell:古细菌病毒编码的抗CRISPR蛋白抑制宿主III型CRISPR-Cas免疫系统
CRISPR-Cas系统是唯一已知的原核生物的适应性免疫系统,用来抵抗病毒和质粒的入侵,存在于40%的细菌和几乎所有的古细菌中。根据基因共同性和核糖蛋白效应复合物的组分,CRISPR-Cas分为1、2类,进一步细分为3种亚型,1类有I、III、IV型,2类有II、V、VI型【1】。CRISPR-Cas免疫系统包含3个步骤:从病毒和质粒基因组中获得新的间隔序列;生成效应复合物-产生CRISPR RNA前体crRNA并且Cas蛋白和成熟crRNA聚集形成复合物;干扰-切割入侵核酸。I、II、V型切割双链DNA,VI型切割RNA,IV型的切割底物未知,而III型系统在底物识别和干扰机制上都具有更高的复杂性。
III型CRISPR-Cas系统包含A-D四种亚型【2】,其中III-A(又叫Csm)和III-B(又叫Cmr)研究最多。III型系统的效应复合物首先和间隔序列的转录本(protospacer transcript)结合,导致Cas10蛋白的活化;Cas10蛋白通过其HD核酸酶结构域对DNA进行非特异性降解。而且,活化的Cas10蛋白通过其palm结构域合成环寡腺苷酸(cyclic oligoadenylates,cOAs)【3】;cOAs通过与III-A型中的RNA酶Csm6和III-B型中的RNA酶Csx1的CARF结构域结合,并激活。体内转录研究表明,当间隔序列位于病毒早期基因中,Csm6在免疫过程是可有可无的;但当间隔序列位于病毒晚期基因中,Csm6则是必不可少的。相对的,Cas10的DNase活性被认为在整个III型系统中不可缺少,但仍需要实验进行证实。而其他III型系统的非特异性RNase在靶向病毒晚期基因过程中的作用目前尚不清楚。
病毒同样进化出多种机制对抗CRISPR-Cas系统,包括间隔序列或PAM的突变和anti-CRISPR蛋白(Acrs)【4】。目前已经发现抑制CRISPR-Cas亚型I-F、I-D、I-E、II-A、II-C、V-A的Acrs,这些Acrs通常具有特异性。但是目前只有低于一半的Acrs其抑制CRISPR-Cas系统的机制是已经确定的,包括破坏CRISPR-Cas效应复合物与DNA的结合和底物的切割。而且,目前没有发现抑制III、IV、VI型CRISPR-Cas系统的Acrs。
2019年9月26日,来自丹麦哥本哈根大学的Xu Peng团队在Cell杂志上发表文章Inhibition of Type III CRISPR-Cas Immunity by an ArchaealVirus-Encoded Anti-CRISPR Protein,发现了III型CRISPR-Cas系统的抑制蛋白AcrIIIB1。AcrIIIB1不和Csx-1直接结合,而是通过与III-B系统中效应复合物Cmr-α、Cmr-γ的相互作用,特异性地抑制III-B系统。

2018年,研究团队在古细菌硫化叶菌(Sulfolobusislandicus)中发现了由SIRV2和SIRV3编码的AcrID1蛋白,AcrID1直接结合I-D系统的效应复合体的最大亚基Cas10d,抑制I-D型系统【5】。考虑到SIRV2能够感染Sulfolobusislandicus LAL14/1,而LAL14/1携带了一种I-A、一种I-D、2种III-B(Cmr-α、Cmr-γ)和13个SIRV2匹配的间隔序列,那么SIRV2中是否存在抑制III型系统的Acrs蛋白?研究人员发现gp48的敲除显著降低病毒对野生型LAL14/1的感染能力,不影响其对删除CRISPR-Cas系统的突变LAL14/1的感染;而且gp48编码的蛋白能够抑制III-B系统,命名为AcrIIIB1。进一步研究发现,AcrIIIB1存在条件下,携带病毒早期基因间隔序列的菌株也能成功抵抗病毒的感染;而携带病毒中/晚期基因间隔序列的菌株不能抑制病毒的感染,提示我们AcrIIIB1抑制菌株的CRISPR-Cas免疫功能。即AcrIIIB1抑制III-B型靶向病毒中/晚期基因,而对III-B型免疫系统靶向病毒早期基因没有功能。
那么AcrIIIB1抑制III-B型系统的机制是什么?之前的研究表明非特异性RNase Csm6对III-A型系统抑制病毒中/晚期基因是必需的;据推断,Cas10的HD DNase结构域对III型系统是必需的,但缺乏直接的数据证明。突变实验表明,III-B系统中Csx1的RNase活性对其靶向病毒中/晚期基因,而不是早期基因,是必需的;而Cmr2α(Cas10)的DNase活性对III-B型系统控制病毒的各时期基因表达都是必需的。这表明AcrIIIB1可能通过抑制Csx1的RNase功能,而不是Cas10的DNase活性,抑制III-B型免疫系统。通过pull-down试验,发现AcrIIIB1和Csx1之间没有直接的相互作用;但AcrIIIB1直接和Cmr-α、Cmr-γ复合物相互作用,抑制古细菌对病毒感染的抵抗。
最后,研究人员对AcrIIIB1的保守性进行探究。之前鉴定的古细菌病毒Acr蛋白AcrID1在几个主要的古病毒家族中都有同源类似物,但AcrIIIB1的同源物仅仅在Rudiviridae和Lipothrixviridae家族中存在。其中几乎所有的Rudiviridae家族成员和一半以上的Lipothrixviridae家族成员都具有AcrIIIB1类似序列。
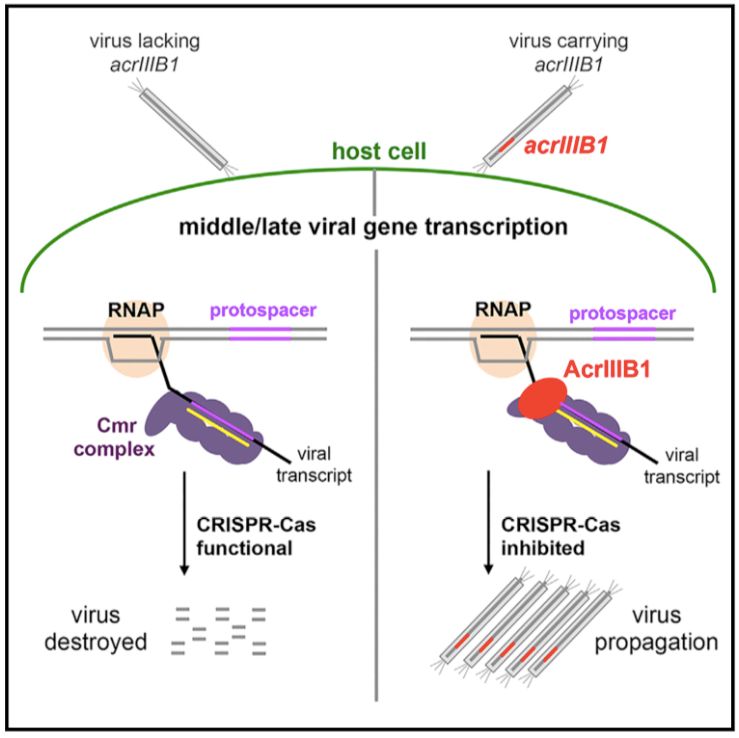
总的来说,该研究在古细菌病毒中鉴定了III型CRISPR-Cas抑制蛋白AcrIIIB1蛋白,并揭示了AcrIIIB1的作用机制—通过直接结合Cmr-α、Cmr-γ效应复合物,抑制Csx1的活化信号,从而实现抑制III-B型免疫系统;为研究CRISPR-Cas系统提供了新的视角。
原文链接:
https://doi.org/10.1016/j.cell.2019.09.003
参考文献
1. Koonin, E.V., and Makarova, K.S. (2017). Mobile Genetic Elements and Evolu-tion of CRISPR-Cas Systems: All the Way There and Back. GenomeBiol. Evol. 9, 2812–2825.
2. Makarova, K.S., Wolf, Y.I., Alkhnbashi,O.S., Costa, F., Shah, S.A., Saunders, S.J., Barrangou, R., Brouns, S.J.,Charpentier, E., Haft, D.H., et al. (2015). An updated evolutionaryclassification of CRISPR-Cas systems. Nat. Rev. Micro- biol. 13,722–736.
3. Han, W., Stella, S., Zhang, Y., Guo,T., Sulek, K., Peng-Lundgren, L., Montoya, G., and She, Q. (2018). A Type III-BCmr effector complex catalyzes the syn- thesis of cyclic oligoadenylate secondmessengers by cooperative substrate binding. Nucleic Acids Res. 46,10319–10330.
4. van Houte, S., Ekroth, A.K.,Broniewski, J.M., Chabas, H., Ashby, B., Bondy- Denomy, J., Gandon, S., Boots,M., Paterson, S., Buckling, A., and Westra, E.R. (2016). Thediversity-generating benefits of a prokaryotic adaptive im- mune system. Nature532, 385–388.
5. He, F., Bhoobalan-Chitty, Y., Van,L.B., Kjeldsen, A.L., Dedola, M., Makarova, K.S., Koonin, E.V., Brodersen,D.E., and Peng, X. (2018). Anti-CRISPR proteins encoded by archaeal lyticviruses inhibit subtype I-D immunity. Nat. Microbiol. 3, 461–469.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652475762&idx=4&sn=fe60da789e5d9d3ee937332cb4d957b9&chksm=84e202c6b3958bd0b92b138f69b19e78482cf99514c7af6c752de1e3843a4a39f56112d6cb6b&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



