来源:BioArt植物
作者:张静,侯岁稳(兰州大学生命科学学院)

脱落酸 (abscisic acid, ABA) 作为经典植物激素之一, 不仅参与植物的生长发育过程, 如种子休眠与萌发、根系统发育、叶片衰老和成花转变, 还在植物逆境响应中起着非常重要的作用 (Dong et al., 2015; Vishwakarma et al., 2017; 伍静辉等, 2018)。拟南芥 (Arabidopsis thaliana) 细胞通过类胡萝卜素途径以β-胡萝卜素作为前体起始ABA的生物合成, 其早期非特异反应在质体中进行, 由玉米黄质环氧化酶 (zeaxanthin epoxidase, ZEP)和9-顺式-环氧类胡萝卜素双加氧酶(9-cis-epoxycarotenoiddioxygenases, NCEDs) 等一系列酶催化产生黄氧素(xanthoxin), 然后转移到细胞质中进行一系列ABA合成的特异性反应, 最终由ABA醛氧化酶(abscisic aldehydeoxidases, AAOs)及其辅酶ABA3催化产生有活性的ABA (Finkelstein, 2013)。ABA通过2条代谢途径失活: (1) 通过细胞色素氧化酶(CYP707As)等氧化产生红花菜豆酸(phaseic acid, PA)和二氢红花菜豆酸 (dihydrophaseic acid, DPA) (Finkelstein, 2013; Weng et al., 2016); (2)通 过 葡糖基转移酶将ABA 转化成脱落酸葡糖酯(ABA-GE), 该产物在植物逆境响应中起重要作用(Lee et al., 2006;Dong et al., 2015)。ABA转运蛋白 (如输出载体ABCG25) 将ABA及其代谢物运出细胞,再将ABA导入维管束进行长距离运输; 或 (如输入载体ABCG22/40) 将ABA重新载入需要的细胞 (如气孔保卫细胞)。这种运输机制是植物响应胁迫的重要方式 (Dong et al., 2015; Merilo et al., 2015)。
ABA信号转导中心通路由受体RCAR/PYR/PYLs、磷酸酶PP2Cs、激酶SnRK2s (SnRK2.2/2.3/2.6) 和 SnRK2s 的底物构成 , 是一个双 抑 制 系 统 (Umezawa et al., 2010)。无ABA信号时, PP2Cs结合并 去 磷酸 化 SnRK2s, 抑 制 SnRK2s 激 酶 活 性 , 使SnRK2s不能激活其底物; 当受体RCAR/PYR/PYLs感知到ABA存在时, 便相互结合, 进一步与PP2Cs结合, 形成三元复合体, 抑制PP2Cs的酶活性, 同时使PP2Cs-SnRK2s复合体解离, SnRK2s发生自磷酸化, 随后通过磷酸化激活转录因子或离子通道等下游底物, 诱导ABA响应基因表达或气孔关闭 (Fujii et al.,2007; Fujita et al., 2009; Ma et al., 2009; Park et al.,2009; Umezawa et al., 2009)。SnRK2s下游底物包括转 录 因 子 ( 主 要 是 ABRE-bindingproteins/ABRE binding factors, AREBs/ABFs)、 钾离子 通 道蛋 白KAT1、阴离子通道蛋白SLAC1 (slow anionchannel1)及其它功能蛋白(TOR激酶、NADPH氧化酶和DNA解旋酶BRAHMA等) (Fujii et al.,2007; Sirichandra etal., 2009; Han et al., 2012; Finkelstein, 2013; Fujitaetal., 2013; Dong et al., 2015; Wang et al., 2018b)。
蛋白质翻译后修饰 (post-translationalmodifications, PTMs) 能调节蛋白质结构、动态变化和生物学功能等, 是真核细胞生命活动中的重要调节方式, 其中常见的有磷酸化、糖基化、甲基化、酰基化、泛素化和硫酸化等(Jensen,2006)。植物细胞中, PTMs参与许多重要生理过程。例如, 蛋白质磷酸化调节植物激素油菜素内酯 (brassinosteroids,BRs) 信号通路 (Belkhadir andJaillais, 2015); 糖基化调控蛋白质合成以及内质网压力响应(Nagashima et al., 2018); 磷酸 化 、 糖 基 化 和 泛 素 化 协 同 参 与 植物 免 疫 过 程 (Withers and Dong, 2017)。本文重点阐述磷酸化、泛素化、类泛素化和氧化还原修饰在ABA信号转导中的作用及其最新研究进展。
1 磷酸化/去磷酸化
蛋白的磷酸化和去磷酸化(phosphorylation/dephosphorylation) 过程由蛋白激酶和蛋白磷酸酶分别完成, 是蛋白最主要的翻译后修饰之一 (Cohen,2002; Humphrey et al., 2015)。在植物中, 蛋白的磷酸化修饰调控是ABA信号中非常关键的调节手段 。RCAR/PYR/PYLs是最主要的ABA受体, 但有关其磷酸化的研究一直没有进展。直到最近,朱健康实验室利用磷酸化组学方法研究发现受体PYL4的114位丝氨 酸 残 基 (PYL4Ser114) 、 PYL1Ser119 和 PYL9Ser94存在磷酸化修饰,且这些位点的磷酸化都会被外源ABA抑制 (Wang etal., 2018b)。PYL4Ser114和PYL1Ser119位点的模拟持续磷酸化突变(丝氨酸突变为天冬氨酸,PYL4S114D、PYL1S119D)会抑制受体与ABA或PP2Cs的结合, 失去抑制PP2Cs酶活性的能力 ;超 表 达 突 变 基 因 PYL1S119D不能恢复突变体pyr1/pyl1/2/4对ABA不敏感的表型。这些证据表明,磷酸化PYL1/4会抑制受体的活性及功能 (Wanget al., 2018b)。
进一步研究发现,在没有ABA或逆境信号条件下,能量代谢关键组分TOR(target of rapamycin) 激酶复合体磷酸化PYL1/4, 使ABA信号被阻断;当受到逆境胁迫后,SnRK2s被激活并磷酸化TOR的调节亚基RaptorB,导致TOR的激酶活性被抑制,使之不能激活能量调节,从而抑制植物生长及促进植物逆境生存。
这些结果表明,TOR激酶复合体和ABA信号相互拮抗调节植物生长与逆境生存(Rosenberger and Chen, 2018; Wang et al., 2018b) (图1)。拟南芥酪蛋白激酶AELs(Arabidopsis EL1-likeproteins, AEL1-AEL4)磷酸化PYL1 Ser136和PYR1Ser109,AELs缺失会降低PYL1/PYR1的泛素化,导致PYR/PYLs降解变慢,说明PYL1/PYR1存在一条磷酸化介导的泛素化降解途径(Chenet al., 2018)。有趣的是,受体不同位点的磷酸化可能起着相反的作用,CARK1 (cytosolic ABA receptor kinase 1) 磷酸化PYL8/PYR1的77/78位苏氨酸残基(T77/T78),导致PYL8/PYR1的稳定性增强,对PP2Cs的抑制作用加强,从而促进ABA信号转导(Zhanget al., 2018)。
当植物感知ABA信号后, SnRK2s的抑制被解除,SnRK2s通过激酶催化域和调节域的分子内互作恢复部分活性,然后自磷酸化活性环中的多个氨基酸残基,恢复 全部的激 酶活性,从而磷酸化下游底物 (Belinet al., 2006; Umezawa et al., 2009; Ng et al.,2011)。SnRK2s除自磷酸化外,BIN2 (brassinosteroid insensitive 2)、BAK1 (BRI1-associated receptor kinase1)、HT1(high leaf temperature 1)和酪蛋白激酶CK2 (casein kinase 2)等多个激酶都能磷酸化SnRK2s(Cai et al., 2014; Tian et al., 2015; Vilela et al., 2015; Shang et al., 2016)。BIN2属于GSK3 (glycogensynthase kinase 3) 激酶家族, 调节多种信号过程: 包括抑制BR信号转导、抑制生长素信号转导和调节气孔运动等,是BR信号通路中的关键组分之一 (Heet al., 2002; Vert et al., 2008; Kim et al.,2012b; Youn and Kim, 2015)。在ABA信号通路中,BIN2磷酸化激活SnRK2.2/2.3(Cai et al., 2014), 同时BIN2也磷酸化激活ABI5 (Hu and Yu, 2014)。
最新研究表明,作为ABA通路中2个关键的PP2Cs—ABI1/2 (ABA-insensitive 1/2), 通过去磷酸化BIN2抑制BIN2激酶活性(Wanget al., 2018a)。这些结果表明,BIN2是整合BR和ABA两大激素信号通路的关键因子(Wangand Wang, 2018) (图1)。另一个BR信号通路中的激酶BAK1也磷酸化SnRK2.6/OST1(openstomata 1), 并与ABI1拮抗调节OST1的磷酸化以及气孔运动(Shang etal., 2016)。CK2是一类高度保守的蛋白激酶,由催化亚基和调节亚基组成异源二聚体或四聚体(Mulekarand Huq, 2014)。玉米(Zeamays) ZmCK2磷酸化ZmOST1碳端结构域中的氨基酸残基,促进ZmOST1与PP2Cs的结合, 从而抑 制 OST1的 活 性 和 ABA信 号 转 导 (Vilelaet al.,2015)。HT1是CO2诱导气孔关闭的一个负调控因子,通过磷酸化抑制OST1的激酶活性,进而抑制气孔关闭(Tianet al., 2015)。此外,MPKs等激酶和PP2A、PP1等磷酸酶都影响SnRK2s的磷酸化水平与激酶活性,但是否直接调控SnRK2s的磷酸化还需进一步验证 (Saruhashiet al., 2015; Waadt et al., 2015; Houet al., 2016)。
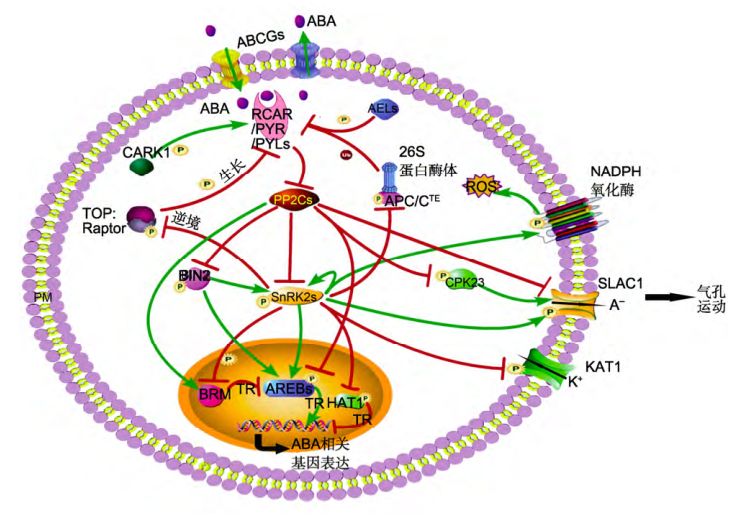
图1 磷酸化修饰在ABA信号中的作用
AREBs/ABFs属于亮氨酸拉链类(bZIP)转录因子,包括ABI5、ABF1-ABF4、OsbZIP23和OsbZIP46等, 结合在ABA响应元件(ABA response element,ABRE)上, 激活或抑制相关基因的表达(Fujita etal.,2013)。AREBs/ABFs被SnRK2s磷酸化, 并被ABI1/2直接去磷酸化 (Fujii and Zhu,2009; Antoni et al.,2012; Fujita et al., 2013; Yoshida et al., 2015;Bhatnagaret al., 2017)。大部分转录因子被SnRK2s磷酸化后激活其转录活性, 如水稻(Oryza sativa)中OsbZIP23被SAPK2 (SnRK2s在水稻中的同源蛋白,参与ABA信号转导)磷酸化后激活其转录活性, 然后促 进 OsNCED4 的 表 达 和 ABA 的 合 成 (Kim et al.,2012a;Zong et al., 2016)。最近研究表明, ABFs被SnRK2s磷酸化后,促进ABI1/2的表达, 随后ABI1/2蛋白量增加,对ABFs的去磷酸化加强,转而抑制ABFs的转录活性,从而形成一条精确调控ABA信号及对ABA进行脱敏反应的反馈通路 (Wanget al.,2018d)。有部分转录因子被SnRK2s磷酸化后转录活性受到抑制。例如,正常条件下,没有磷酸化的HAT1(homeodomain-leucinezipper protein 1) 结 合 在NCED3的启动子上,抑制NCED3的表达和ABA合成; 在干旱条件下,HAT1被SnRK2s磷酸化, 其转录抑制活性被抑制,导致植物体内ABA含量上升,以响应干旱胁迫(Tanet al., 2018)。除SnRK2s和PP2Cs外, 还有多种激酶或磷酸酶参与调控AREBs/ABFs磷酸化修饰 。例如,苹果 (Malusdomestica) MdMKK1-MdMPK1级联通路磷酸化MdABI5 (Wang et al.,2010b); BIN2和PSK5(SOS2-like protein kinase 5)磷酸化激活ABI5 (Hu and Yu, 2014; Zhou etal.,2015); 磷酸酶PP6和PP2A去磷酸化ABI5(Dai et al.,2013; Hu et al., 2014); 苹果中钙依赖蛋白激酶MdCIPK22磷酸化MdAREB2 (Maet al., 2017)。在ABA促进气孔关闭的过程中,SnRK2s磷酸化激活SLAC1,促进阴离子(A–)外排; ABI1直接去磷酸化SLAC1,抑制气孔关闭。同时SnRK2s磷酸化抑制KAT1的活性, 阻止钾离子(K+)内流 (Geiger etal.,2009; Sato et al., 2009)。SnRK2s还磷酸化bHLH (basic helix-loop-helix) 类转录因子AKS1(ABA-responsive kinase substrate 1), 促使AKS1解聚成单体形式, 失去结合靶基因KAT1的能力, 从而抑制KAT1的表达(Takahashiet al., 2016, 2017b)。除此通路外, ABI1还通过去磷酸化钙蛋白激酶CPK23, 抑制CPK23对SLAC1的磷酸化,形成一条独立于SnRK2s的调节气孔运动的通路 (Geigeret al., 2010) (图1);CPK6也磷酸化SLAC1,部分取代OST1的功能 (Brandtet al., 2012)。激酶GHR1(guard cell hydrogen peroxide-resistant 1)磷酸化激活SLAC1, 参与ABA调节的气孔关闭,该过程被ABI2抑制, 但不被ABI1抑制 (Hua etal., 2012)。另外,在CO2诱导的气孔关闭过程中,HT1不仅抑制OST1,还通过磷酸化抑制GHR1和SLAC1。而CO2能促进MPK4/MPK12磷酸化抑制HT1的激酶活性 (Tianet al., 2015; Hõrak et al., 2016)。SnRK2s还磷酸化其它的功能蛋白,使植物感应ABA信号后出现多种生理变化。例如,磷酸化NADPH氧 化 酶 AtrbohF,促 进 ABA诱 发 的 活 性 氧 爆 发(Sirichandraet al., 2009); 磷酸化TOR激酶的调节亚基RaptorB,抑制植物生长(Wanget al., 2018b)。BRM(BRAHMA)是SWI/SNF染色体重组复合体中的关键组分,结合ABI5的基因序列并抑制ABI5表达。SnRK2s (或ABI1)对BRM的磷酸化(或去磷酸抑制(或稳定) BRM与ABI5基因的结合(Hanet al., 2012;Peirats-Llobet et al., 2016)。
2 泛素化
泛素是真核生物中高度保守的一类小肽,由76个氨基酸残基组成,它通过共价连接的方式,即泛素化(ubiquitination)修饰蛋白的赖氨酸残基。泛素化过程通常经一系列连续的催化反应,由E1泛素激活酶、E2泛素结合酶和E3泛素连接酶将泛素连接到靶蛋白(Yuet al., 2016b)。在拟南芥中,E1和E2两种酶类编码基因较少,E3连接酶的编码基因约有1500个, 根据E3结构和与E2互作的特异性,可将E3连接酶分为4大类: HECT(homology to E6-AP C-terminus)类、RING (really interesting new gene)类、U-box类以及CRL(cullin-ring)类(Yu et al., 2016b; Miricescu et al., 2018)。泛素化修饰根据连接泛素的数量和方式可分为单泛素化、多泛素化和多聚泛素化。单泛素化或多泛素化主要起修饰蛋白功能和调节蛋白定位等作用;多聚泛素化通常 偶联蛋白酶体(ubiquitin/26Sproteasome, Ub/26S体系)进行蛋白质的选择性降解 (Miricescuet al., 2018)。目前发现的与ABA信号转导有关的泛素化修饰几乎都是多聚泛素化。
最早报道参与ABA信号调控的RING类E3泛素连接酶是AIP2(ABI3-interacting protein 2), 其通过泛素化ABI3参与胚胎发育和ABA信号转导(Kurupet al., 2000; Zhang et al., 2005)。KEG (keep on going) 是一个重要的调控ABA信号转导的RING类E3, 定位在细胞质中的反面内质网和早期内体(trans-Golginetwork/earlyendosome, TGN/EE)上, 将核定位的ABI5、ABF1和ABF3招募到TGN/EE进行降解,同时KEG泛素化ABI5的激酶CIPK26(Stone et al., 2006;Chen et al., 2013b; Lyzenga et al.,2013)。当植物感知ABA后, 会促进KEG的自泛素化和降解,从而减少由KEG介导的ABI5降解, 促进ABA信号响应(LiuandStone, 2010)。当CIPK26被激活后磷酸化KEG,随后也会增加KEG的自泛素化和降解(Lyzengaet al.,2017)。从这些结果可以推测,当ABA或逆境胁迫激活CIPK26后, CIPK26磷酸化KEG和ABI5, 激活ABI5的转录活性, 促进KEG自泛素化和降解, 进一步导致KEG介导的CIPK26和ABI5降解减少, 从而增强植物对ABA的响应(图2)。RSL1(single-subunit ring-typeE3 ubiquitin ligase)泛素化并促进降解PYL4和PYR1(Bueso et al.,2014)。ABA促进RGLG1/5 (ringdomainligase 1/5)对PP2CA的泛素化 (Wu et al.,2016); 辣椒 (Capsicum annuum)中RING类E3泛素酶CaAIRF1降解CaADIP1 (一个ABA信号途径中的PP2C) (Lim et al.,2017); AtAIRP3 (ABA-insensitivering protein 3)通过促进RD21 (responsive todehydration 21)的降解来调节植物对ABA介导的干旱胁迫响应(Kim and Kim, 2013)。玉米中的RING类E3连接酶ZmXERICO1泛素化调控ZmABA8ox3a (拟南芥CYP707A的同源蛋白)的蛋白稳定性, 从而调节干旱胁迫下植株体内ABA的平衡, 而其在拟南芥中的同源蛋白XERICO也参与ABA的合成(Ko et al.,2006; Brugière et al., 2017)。
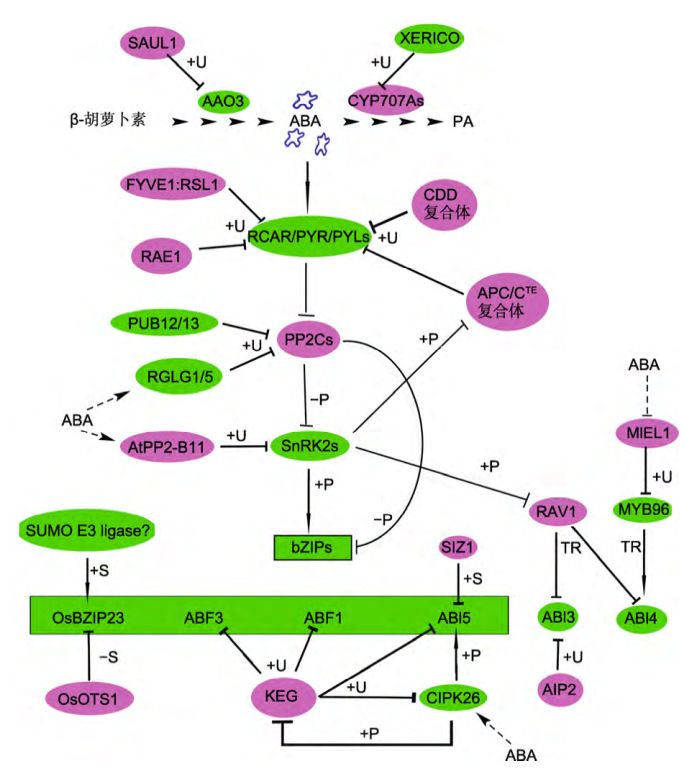
图2 蛋白泛素化和SUMO化修饰调节ABA合成代谢、识别、转导和响应
CRL类E3连接酶复合体均由1个支架蛋白CULs(Cullins)和负责底物招募的接头蛋白组成, 是拟南芥中最大的一 类 泛 素 化 修 饰 酶 (Hua andVierstra,2011)。BPMs (Meprin and TRAF homology/Bricabrac-tramtrak-broadcomplex, MATH/BTB) 是与CUL3相连的接头蛋白, 通过泛素化促进ABA信号的负 调 节 转 录 因 子ATHB6降 解 (Himmelbach et al.,2002; Lechner et al.,2011)。随后又发现BPM与另一个转录因子RAV1 (related toABI3/VP1) 互作; 而RAV1被SnRK2s磷酸化后会失去对ABI3/4/5的转录抑制能力 (Chen et al.,2013a; Feng et al., 2014)。DWA1/2 (DWD hypersensitive to ABA 1/2)是2个同源的CUL4-DDB1 (damagedDNA binding1)-DWD(DDB1 binding WD40)复合体的接头蛋白, 与ABI5互作, 调节ABI5的积累和ABA响应 (Lee et al., 2010)。另一个CUL4-DDB1复合体的接头蛋白ABD1 (ABA hypersensitiveDCAF1)也通过泛素化调节ABI5的蛋白积累。 abd1突变体与dwa1-1/dwa2-1双突变体表型相似, 在种子萌发和幼苗生长阶段都对外源ABA超敏感 (Seo et al., 2014)。由DDB1、COP10 (constitutivephotomorphogenic 10) 、 DET1 (deetiolated 1) 、DDA1(DDB1-associated 1)和CUL4组成的CDD复合 体 通 过 Ub/26S 体 系 降 解 PYL8, 参 与 ABA 响应 (Irigoyen et al.,2014)。最新报道显示CUL4–DDB1-RAE1 (RNAexport factor 1 in Arabidopsis)复合体可降解PLY9, 从而参与植物对ABA和干旱胁迫的响应 (Li et al., 2018)。AtPP2-B11是一个F-box蛋白,与CUL1和SKP1 (S-phasekinase-associated protein 1)组成SCF (SKP1-Cul1-F-box ligases) 泛素复合体, 利用Ub/26S体系促进SnRK2.3的降解, 但不会影响SnRK2.2/2.6的稳定性, 说明AtPP2-B11特异性地招募底物SnRK2.3 (Cheng etal., 2017)。RIFP1(RCAR3interacting F-box protein 1)与ASKs (Arabidopsis SKP1-like proteins)组成SCF复合体, 通过泛素化RCAR3/PYL8, 促进PYL8的降解, 抑制ABA信号转导(Li et al., 2016)。TE (tillerenhancer)是水稻APC/CTE (anaphase promotingcomplex/cyclosome) 泛素复合体中的激活子, 参与调控水稻株型发育(Linet al., 2012)。在ABA信号途径中, SAPKs被ABA激活后磷酸化TE, 抑制APC/CTE复合体的泛素化活性, 导致APC/CTE复合体不能泛素化降解OsPYL/RCAR10,进一步增强ABA响应(Lin et al., 2015)。CSN(COP9signalosome)复合体可解除CULLIN蛋白的NEDD修饰 (de-neddylation), 调 节 CRL 复 合 体 的 活 性 ,CSN5A促进ABI5的降解, 参与调节种子休眠和萌发,但具体机制还不清楚(Lyapina et al.,2001; Jin et al.,2018)。
SAUL1 (senescence-associated E3 ubiquitin ligase 1) 是U-box类E3连接酶, 通过Ub/26S体系降解AAO3, 参与调节叶片衰老和ABA合成(Raab et al.,2009)。多个PUBs (plant U-boxE3 ligases)直接调控ABA中心组分的降解。PUB22/23泛素化PYL9, 并与多 个 PYLs 互 作 (Kong et al., 2015)。 ABA 促 进PUB12/13 对 ABI1 的 泛 素 化 及 降 解 (Zhao et al.,2017)。AFPs (ABI5-bindingproteins)与ABI5和ABFs互作, 促进ABI5与E3泛素连接酶互作及降解(LopezMolina etal., 2003; Garcia et al., 2008)。在水稻中, AFPs 的 同 源 蛋 白 MODD (mediator ofOsbZIP46 deactivation and degradation)与ABI5的同 源蛋白OsbZIP46 互 作 , 增 强 E3 连 接 酶 OsPUB70 对 OsbZIP46的泛素化修饰, 促进OsbZIP46降解, 抑制ABA或逆境信号过度响应 (Tang et al., 2016)。
此外, RING类泛素酶SDIR1、U-box类泛素酶CHIP、PUB18多种泛素连接酶参与调控ABA响应,但其底物并非ABA中心转导途径组分(Luo et al.,2006;Zhang et al., 2015a; Seo et al., 2016; Yu et al., 2016b)。例如, RING类E3连接酶MIEL1(MYB30-interacting E3 ligase 1)降解MYB类转录因子MYB96和MYB30, 该过程被ABA抑制。而ABA激活MYB96, 促进其靶基因ABI4的表达(Lee et al., 2015;Lee and Seo, 2016) (图2)。Exo70B1是泡外复合体 (exocystcomplex)的一个亚基,参与细胞的胞吞、胞吐和囊泡运输等过程,是ABA信号中的正调节因子,PUB18通过促进Exo70B1的降解参与调控ABA和逆境胁迫响应(Kulichet al., 2013; Seo et al., 2016)。
泛素化后的降解途径还有几条不依赖于26S蛋白酶体,称之为非26S蛋白酶体内膜转运体系,包括胞内体转运(endosomaltrafficking pathway)和自噬泡途径。这里简要介绍一下这类降解途径在ABA信号中的作用,详情可以参阅文献 (Yuand Xie, 2017)。RSL1和PYL4共定位在细胞质膜和TGN/EE上, 当用囊泡运输抑制剂BFA处理后, PYL4在微粒体中的积累增加,表明被RSL1泛素化的PYL4不仅通过Ub/26S体系降解,还可能存在其它降解途径 (Buesoet al.,2014)。ESCRTs(endosomal sorting complex required for transport proteins)是胞内体转运途径中关键 的 复 合 体 ,其 组 成 成分 包 括 FYVE1和 VPS23A(Zhuanget al., 2015)。FYVE1和VPS23A都能与PYL4在胞内体上互作,在fyve1和vps23a突变体中可观察到被多聚泛素化标记的PYL4在内吞泡中积累,说明ESCRT-1复合体通过筛选和运输被RSL1泛素化的PYL4到胞内体转运途径进行降解(Belda-Palazonetal., 2016; Yu et al., 2016a)。ABCG25是ABA的输出载体, 其在质膜上的定位受到ABA和逆境胁迫的调节。在逆境胁迫下,ABCG25通过胞吞作用从质膜转运到胞内体;外源ABA处理后, ABCG25从胞内体转移 到 质 膜 ,该 循 环 过 程 依 赖 于网 格 蛋 白 和 AP-2(adaptor protein complex-2)复合体, 其中ABCG25蛋白积累水平的变化可能依于液泡降解途径(Kuro[1]moriet al., 2016)。
3 类泛素化
SUMO是一类由110个氨基酸残基组成的小肽, 与泛素化过程类似,其连接过程由SUMOE1激活酶、SUMOE2结合酶和SUMOE3连接酶级联催化完成。SUMO修饰 (类泛素化,SUMOylation)后会改变靶蛋白的亚细胞定位、表面结构和催化活性以及抑制靶蛋白的泛素化修饰等。蛋白的SUMO修饰参与植物多种生命活动,包括逆境适应、胚胎发育和植株形态建成等重 要 过 程(Castro et al., 2012; Augustine and Vierstra, 2018; 韩丹璐等,2018)。拟南芥AtSIZ1是较早报道的参与ABA信号和植物逆境响应的SUMOE3连接酶。生化实验证明,SIZ1能SUMO化ABI5的391位赖氨酸(K391)残基, 增加ABI5的蛋白稳定性。从生化结果推测,siz1突变体对ABA的响应与abi5突变体相似,但siz1对ABA敏感性增强,应该与abi5-4的表型相反 (Catalaet al., 2007; Miura et al., 2009)。由于生 化 结 果 不 符 合 生 理 表 型 , 因 此 推 测 被 ABI5的SUMO化不仅影响它的泛素化,还可能影响ABI5的其它修饰(如磷酸化),导致ABI5不能被激活,所以SIZ1最终抑制ABI5响应ABA的能力(Miura etal.,2009; Yu et al., 2015)。MYB30是ABA响应的负调节因子, 与ABI5协同调节ABA信号。SIZ1还能SUMO修饰 MYB30, 增 强 MYB30的 稳 定 性 (Zhenget al.,2012)。OsOTS1(overly tolerant to salt 1)是水稻中的SUMO蛋白酶, 在响应ABA和干旱胁迫过程中催化靶蛋白OsbZIP23去SUMO修饰。ots1突变体的干旱耐受性增强,植株体内OsbZIP23的SUMO修饰增强,蛋白积累增加。上述结果表明,OsbZIP23的SUMO修饰有利于增强蛋白的稳定性和转录活性(Srivastavaet al., 2016, 2017)。此外, 还有多个SUMO修饰相关酶 类 参 与ABA信 号, 但 其 具 体 机 制 尚 不 清 楚,如SUMOE2 结 合 酶 AtSCE1a,E3 连 接 酶 ASP1和MMS21,SIZ1在水稻、番茄(Solanumlycopersicum)、石斛兰(Dendrobium)和苹果等植物中的同源蛋白,以及去SUMO修饰酶ULP1c (Loiset al., 2003; Parket al., 2010; Zhang et al., 2013, 2016, 2017; Liu et al.,2015; Castro et al., 2016; Wang et al., 2018c)。
4 氧化还原修饰
ABA促发包括活性氧、活性氮及钙离子在内的多种信号分子,以响应多种生理过程(Kimet al., 2010; Finkelstein, 2013; Qi et al., 2018)。过氧化氢(H2O2)等活性氧分子和一氧化氮(NO)等活性氮分子也是蛋白调节子,通过调节蛋白的半胱氨酸残基(Cys)氧化还原状态,即氧化还原修饰(redox)参与多种生理过程。例如,植物SnRK1激酶复合体活性受到H2O2或还原性谷胱甘肽(GSH)的调节(Wurzingeret al., 2017); 被氧化 或 过 度 磷 酸 化 的 MPK4 会 发 生 聚 集 和 失 活(Zhang etal., 2015b); 被H2O2激活的MPK6磷酸化硝酸还原酶NIA2促进NO合成(Wang et al.,2010a)。在ABA信号通路中, 谷胱甘肽过氧化物酶AtGPX3(glutathioneperoxidase 3)调节H2O2的内平衡, 同时H2O2氧化AtGPX3, 而氧化态AtGPX3促进ABI2从还原态转变为氧化态, 从而抑制ABI2的酶活性(Miao etal., 2006)。最新研究发现, 欧洲油菜(Brassica na[1]pus)中的OST1同源蛋白BnSnRK2.6-2C的半胱氨酸残基被氧化成亚磺酸或磺酸, 导致其自磷酸化活性被抑制(Ma et al., 2018)。
NO作为调节子通常通过蛋白的氧化还原修饰(由过氧亚硝基介导的酪氨酸残基硝化(nitration)和由S-亚硝基谷胱甘肽 (GSNO)介导的半胱氨酸残基亚硝基化 (nitrosylation))在生物体内发挥作用。半胱氨酸的亚硝基化是可逆的翻译后修饰; 而酪氨酸的硝化会导致蛋白结构不可逆改变或使蛋白降解(VandelleandDelledonne, 2011; Mur et al., 2013; 王宇和何奕騉, 2017; Begara-Morales et al., 2018)。在ABA信号中, NO是负调节因子(Lozano-Juste andLeón,2010; Arc et al., 2013)。受ABA诱导的活性氮硝基化多个ABA受体PYR/PYL/RCARs, 而被硝化的受体再被多聚泛素化后降解(Castillo et al.,2015)。NO的供体GSNO和亚硝基半胱氨酸Cys-NO以一种剂量依赖性的方式亚硝基化OST1的Cys137, 并抑制OST1的激酶活性。ABA促进OST1亚硝基化(Wang et al.,2015)。ABI5的表达受ABA和NO的清除剂cPTIO强烈诱导, 被NO的供体SNAP抑制。同时GSNO和SNAP促进ABI5通过26S蛋白酶体途径的降解 。ABI5的Cys153被亚硝基化, 导致其被KEG和CUL4泛素复合体偶联的蛋白酶体降解(Albertos et al.,2015)。由以上研究结果可以推测, ABA诱导的活性氮促进受体的硝基化, 增加OST1和ABI5的亚硝基化, 从而抑制这些蛋白的活性和ABA信号的过度响应, 由此形成一种反馈调节机制, 精确地调节ABA信号。
5 总结与展望
ABA信号转导过程是一个复杂的协同作用的交互网络,除上文详细阐述的关键组分外,还有多种重要组分参与ABA信号转导和响应,包括由质体定位的受体CHLH(H subunit of the Mg2+ Cheletase)或质膜定位的 受 体 GTG1(G-protein coupled receptor-typeG-proteins)介导的2条不依赖于受体PYR/PYL/RCARs的ABA信号转导途径(Shenet al., 2006; Pandey et al., 2009); 由钙离子依赖蛋白激酶CDPKs、MPKs和SnRK2s等激酶组成的磷酸化调控网络(Umezawaet al., 2014); 由ABF/AREB、DREB(dehydration responsive element binding protein)、NAC、WRKY和MYB/MYC等转录因子组成的转录调控网络(Fujitaetal., 2011; Singh and Laxmi, 2015)。这些组分之间通过相互作用来调控ABA信号。例如,ABF4的转录活性依赖于与钙依赖蛋白激酶AtCPK32的互作(Choi et al.,2005); 棉花(Gossypiumhirsutum)响应干旱过程中GhMAP3K15-GhMKK4-GhMPK6级联通路磷酸化GhWRKY59(Li et al., 2017); RGLG1/2泛素化转录因子AtERF53负调节干旱响应(Chenget al., 2012);在ABA诱导气孔关闭过程中,CHLH被磷酸化,并与SnRK2.6/OST1存在互作(Lianget al., 2015)。
随着技术的进步,目前已经鉴定到200多种不同类型的PTMs,已报道多种PTMs参与ABA信号途径。例如,半胱氨酸残基的酰化 (Batističet al., 2012)及法尼基修饰(Brady et al., 2003; Huizinga et al.,2010), 氨 基酸 残 基 的 乙酰 化 修 饰 (Linsteret al.,2015)。但这些修饰参与调控ABA信号的分子机制并不清楚。虽然磷酸化和泛素化在ABA信号转导中的作用研究得比较深入,但也存在诸多问题和挑战。例如,泛素化和SUMO修饰都是可逆的过程,但去泛素酶或去SUMO酶的报道都很少;对ABA信号转导的研究主要集中在中心转导途径,对其它途径尤其是这些组分的翻译后修饰研究较少,也需要深入探索。多种修饰会作用于同一个靶蛋白,那么这些修饰之间如何协同作用?这些修饰是否与蛋白的定位改变或响应不同的环境信号有关?ABI5的几种修饰之间如何协同作用?根据已有文献的报道结果可以假设:没有ABA或逆境刺激时,ABI5被SUMO修饰, 处于稳定的非活性状态,而当ABA或逆境激活其激酶后,ABI5被迅速去SUMO化, 同时被磷酸化,导致其转录活性被激活,从而促进ABA有关基因表达,使植物适应逆境;当 逆 境 信 号 消 失 后 ,ABI5 被 泛 素 化 随后 转 运 到TGN/EE被降解, 使植物对ABA脱敏感, 转为生长状态。一些蛋白的同一种修饰会引起相反的效应,如ABA受体PYR1的2个磷酸化位点(T78和S136), 那么植物如何感知不同位点修饰引起的效应?靶蛋白不同位点的修饰是否会引起蛋白构象的不同变化, 从而引起不同的效应? 通过分析靶蛋白在响应ABA过程中的翻译后修饰变化, 发现植物可以快速精准地启动或抑制ABA信号, 从而适应逆境或迅速恢复生长, 但这些过程是否需要其它因子的帮助, 如磷脂肌醇信号(Takahashi et al., 2017a), 还有待探明。回答上述问题可以让我们更全面地理解多种蛋白质翻译后修饰之间的关系, 更深入地揭示植物响应ABA或逆境胁迫的机制, 以及更清晰地认识植物生长与逆境生存之间的微妙平衡。
论文原文链接:
http://www.chinbullbotany.com/CN/10.11983/CBB18217
来源:bioartplants BioArt植物
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3ODY3MDM0NA==&mid=2247492302&idx=4&sn=89bf1369defc3d539acf04aab35d28f1&chksm=fd7378a9ca04f1bf9069903b1b084c87e61d60548ce4ef90edeea02266f412eefb1875e79d72&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn