来源:BioArt
铁是维持生命最重要的金属元素之一,是胞内氧化还原、电子传递及功能酶类的重要组成部分。但是铁过量又不利于细胞生存。因此,病原微生物要想成功的感染人体必须突破人体营养免疫屏障获得适量的铁。为了实现这一目的并维持细胞内铁的稳态,微生物可以根据环境中铁含量的高低时序调控近100个铁代谢相关基因的表达。对于绝大多数微生物来说,这种全局性铁离子调控系统的核心是铁转录因子Fur(ferric-uptakeregulator protein)。经典的Fur调控模型是:在铁丰富条件下,Fur与Fe2+结合形成二聚体并结合在靶基因启动子区的Fur BoxDNA上,从而阻止RNA聚合酶与启动子结合,起到抑制铁吸收系统基因表达的作用;当细胞内缺铁时,Fur 失去铁离子并且失去 DNA 结合能力,因而解除其对靶基因的抑制作用,相关基因上调表达【1】。
在前期的研究中作者意外发现:YdiV及其同源蛋白STM1697除了调控鞭毛的表达外,在缺铁和细菌入侵宿主时表达量显著上调。这表明YdiV可能参与鞭毛合成以及铁代谢系统的协同调控。由于质谱检验YdiV纯度时发现微量Fur的稳定存在,作者猜想这两个蛋白质或许存在直接的相互作用,于是在大肠杆菌中共表达这两个蛋白质观察其是否形成复合物。结果非常意外,虽然YdiV和Fur不能形成复合物,但纯化出的Fur却完全丧失了DNA结合能力,即使外加铁离子也没有影响。经实验验证,细胞内过表达YdiV可以改变Fur的构象。
由于YdiV不可能具有改变Fur结构的功能,作者猜测某种异构酶或许参与了这一过程。为了捕获这一未知蛋白质,作者再次使用质谱技术鉴定纯化后Fur中含有的杂质蛋白。这一次作者注意到了分子伴侣-脯氨酰顺/反异构酶SlyD。尽管这是一个臭名昭著的镍柱污染蛋白质,但作者还是决定检验一下它的功能。结果,当敲除大肠杆菌slyD基因之后,YdiV丧失了转化Fur的能力。这表明YdiV调控Fur依赖于SlyD的介导。有趣的是SlyD同样不能和Fur形成稳定复合物。这说明整个调控发生在蛋白质折叠过程中,YdiV和SlyD可以改变Fur的折叠通路导致蛋白质三维结构的改变从而影响其转录功能。
这一最新发现大幅度改写了经典的细菌铁代谢调控模型:在缺铁条件下,大肠杆菌上调ydiV基因表达,高浓度的YdiV促进脯氨酰顺/反异构酶SlyD催化Fur蛋白DNA结合结构域中第18位的脯氨酸异构化。这一相互作用改变了Fur的构象,使Fur的DNA结合活性丧失,进而激活大肠杆菌铁吸收系统基因表达。这一新型的调控机制不依赖于Fur与Fe2+的结合,可以在细胞内真正缺铁之前有效增加铁的吸收。而原有调控模型依赖于细胞内铁离子浓度的急剧下降,这显然不利于细胞内铁稳态的维持。
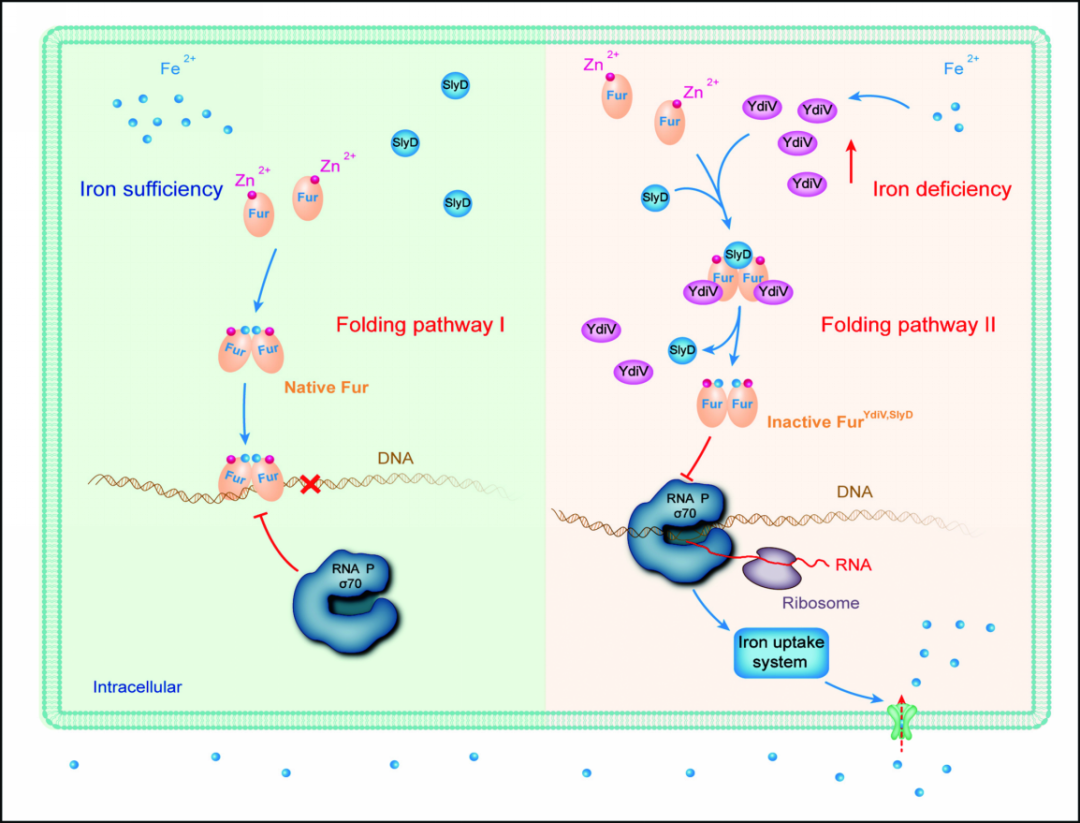 图2.YdiV-Fur-SlyD介导的新型铁代谢调控机制。
图2.YdiV-Fur-SlyD介导的新型铁代谢调控机制。值得注意的是,YdiV-Fur-SlyD互作机制可以协调细菌铁稳态和鞭毛合成,有利于病原菌克服宿主的营养免疫并逃避免疫识别。这对于细菌致病性至关重要。本研究也发现YdiV和SlyD对于尿路致病性大肠杆菌UPEC入侵膀胱上皮细胞是必须的。
通常,分子伴侣蛋白促进底物蛋白质折叠但不改变底物蛋白的最终结构。本研究首次发现,脯氨酰顺/反异构酶SlyD不仅可以促进蛋白质折叠,还可以在YdiV的帮助下改变底物蛋白Fur的最终构象。这一新的发现加深了人们对分子伴侣蛋白的认识。
铁元素是细胞内氧化还原、电子传递及功能酶类的重要组成部分,但却也不是多多益善,过多的铁离子会对细菌生长起反作用,而铁离子不足对细菌也是致命的。很多微生物通过产生铁载体(siderophore)类物质来掠夺环境中的铁离子而起到抗生素的作用。因而细菌进化出了一套能精确调控胞内铁离子浓度的通路。其中铁摄取调节子(ferricuptake regulator, Fur)是细菌铁离子代谢中最重要的调节子。但是我们对于细菌在铁离子极端匮乏的情况下如何摄取能供其正常生活所需的足够二价铁离子还知之甚少。以大肠杆菌为研究对象,山东大学谷立川教授课题组借助生理生化以及蛋白分子结构分析揭示了大肠杆菌在铁离子匮乏的环境下能激发鞭毛形成抑制基因YdiV的过表达。胞内高浓度的YdiV与肽酰-脯氨酰-顺反式异构酶(peptidyl-prolylcis-trans isomerase) SlyD协同作用进一步改变Fur的构象,使其无法结合到DNA上,从而解除了Fur二聚体对铁离子摄入系统的抑制作用,开启铁离子的摄取通路,使得更多的铁离子得以进入细胞,维持胞内铁离子稳态,让细菌能正常生长。此外,作者们还通过细菌侵入试验证明ydiV 和slyD两个基因是尿路致病型大肠杆菌在膀胱上皮细胞中存活所必需的。背后的机制是因为YdiV不仅能抑制鞭毛形成从而逃避被宿主免疫系统识别,还能促进在低铁环境下开启铁摄取通路摄取足够的铁离子得以生存。本研究对于后续有针对性的开发靶向铁离子摄取途径的新型抗生素具有重要的指导意义。
参考文献
[1] HantkeK. Iron and metal regulation in bacteria. CURR OPIN MICROBIOL. 2001, 4:172-177.[2] Deng Z, Wang Q, Liu Z, Zhang M, et al.Mechanistic insights into metal ion activation and operator recognition by theferric uptake regulator. Nat Commun. 2015, 6:7642[3] LeeJW, Helmann JD. Functional specialization within theFur family of metalloregulators. Biometals.2007, 20(3-4):485-99.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652499675&idx=6&sn=c0b4a72434ef28c856451c1233e35f62&chksm=84e27d6fb395f479a2565b0da0698f00237820927d8644edbede6698440a084ca5bfa77401ca&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



