华东理工大学化学与分子工程学院、费林加诺贝尔奖科学家联合研究中心教授贺晓鹏,中国医药工业研究总院研究员奕栋,中国科学院外籍院士、得克萨斯大学奥斯汀分校教授Jonathan Sessler合作,发展了一种新型糖靶向的超高分辨可视化工具,实现了对细菌微结构、抗生素处理后结构形变的动态原位超高分辨示踪,为抗生素抗菌机制的原位可视化研究提供了新的化学工具。相关研究发表于《美国科学院院刊》。
人类与超级细菌的博弈,往往受制于新抗生素漫长的研发周期,以及对其作用机理的深入解析,而多重细菌耐药更是一项极难攻克的临床难题。发展新型的可视化工具,直观地在细菌原位观测其与抗生素相互作用的过程,或可为新发现的抗菌药物机制探索提供依据。
基于上述关键问题,研究人员针对临床常见的致病菌铜绿假单胞菌的一种外膜凝集素Lec A,构建了带有标签修饰的半乳糖双亲分子,并通过分子自组装形成内腔可携载不同结构抗生素的多价糖基胶束,再利用其与Lec A的高亲合力多价相互作用黏附锚定于细菌外膜。测试结果显示,在不同波长光源的交替辐射下,糖基胶束不但可以因为结构的改变而控制释放抗生素,还可原位产生“荧光闪烁”信号。进一步地,研究团队用2种临床一线的抗生素,即头孢他啶和左氧氟沙星,对细菌进行了处理。结合STORM超高分辨显微技术,能够动态示踪细菌微结构及与抗生素互作后的差异化结构形变过程。
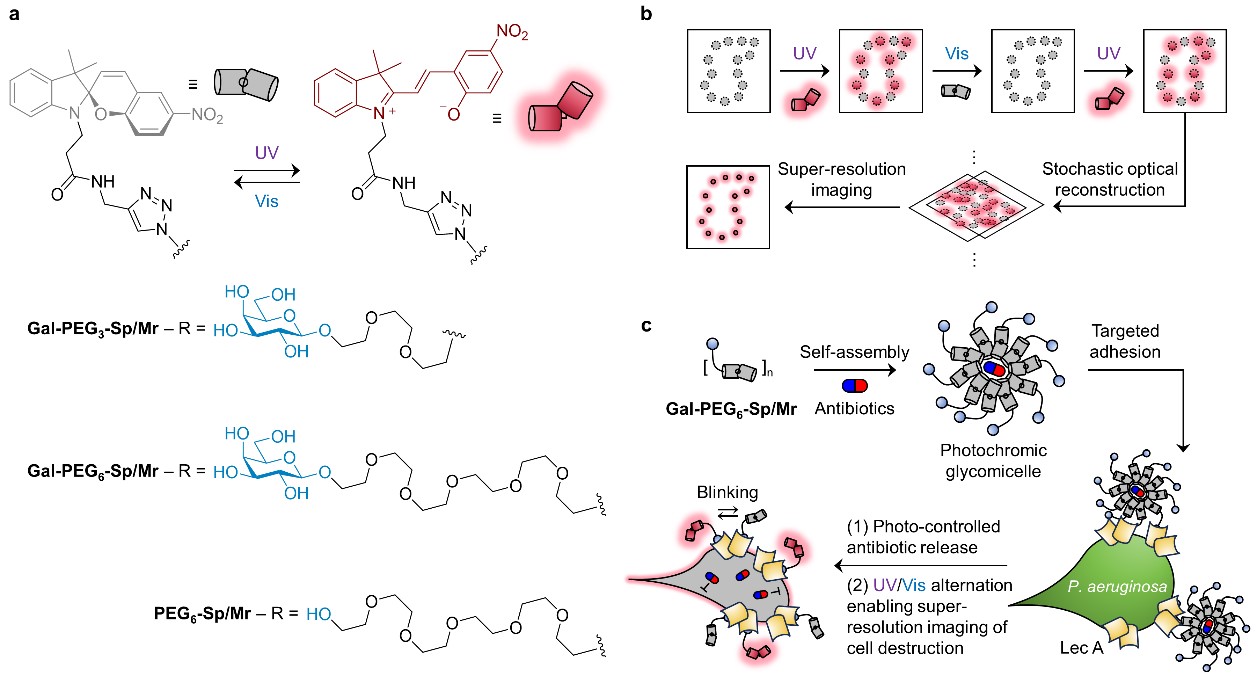
研究图示。图片来源于《美国科学院院刊》
相关论文信息:https://doi.org/10.1073/pnas.2408716121