来源:BioArt
细胞自噬是一个保守的依赖溶酶体的降解循环途径。哺乳动物细胞在营养匮乏等条件下形成自噬体,自噬体再与溶酶体融合后形成自噬溶酶体并对其底物进行降解。这一过程会迅速消耗细胞内的溶酶体。为了维持细胞内溶酶体的稳态,自噬溶酶体会发生管化,回收并生成新的溶酶体。这一过程被称为自噬溶酶体再生【1】。自2010年首次报道自噬溶酶体再生现象以来,俞立课题组先后筛选并鉴定出一系列参与调控自噬溶酶体再生的分子,并通过详实的细胞生物学研究揭示了一个基于PI(4,5)P2,网格蛋白(Clathrin)和马达蛋白(Kif5B)等分子机器调控的自噬溶酶体管化与再生的机制【2, 3】,为理解自噬溶酶体管化以及普遍的生物膜管化机理作出了重要的贡献。
2019年8月16日,清华大学生命学院王宏伟课题组和俞立课题组合作在Nature Communications上发表题为“WHAMM initiates autolysosome tubulation by promoting actinpolymerization on autolysosomes”的学术文章。在本次工作中,王宏伟和俞立合作共同指导的博士研究生代安邦首次发现WHAMM蛋白在自噬溶酶体再生机制中发挥重要作用。

WHAMM蛋白是促进Arp2/3蛋白复合体介导分枝状微丝骨架形成的重要激活因子,然而其参与的生物学过程尚未明确。他们首先通过建立稳定表达带有荧光标签的WHAMM的NRK细胞系,发现WHAMM在自噬溶酶体上有着明显的定位。而后结合荧光显微镜和电子显微镜手段,进一步发现在WHAMM敲除的NRK细胞中,自噬溶酶体再生过程中重要的管化现象有着显著的减少,并伴随着巨大的自噬溶酶体的累积,表明自噬溶酶体的再生发生异常。
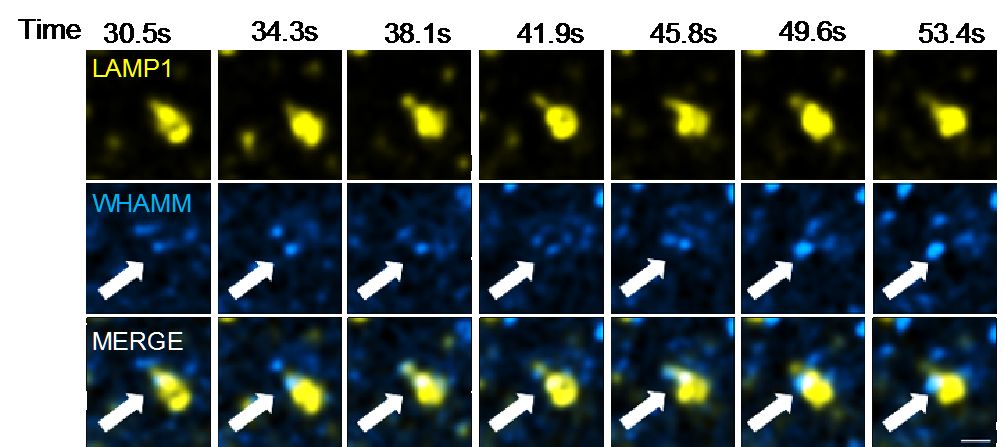
通过对WHAMM蛋白自身的功能的探索,研究进一步揭示了WHAMM通过N-端两段两亲性的螺旋序列与自噬溶酶体表面的磷脂PI(4,5)P2特异性结合,并在自噬溶酶体表面介导分枝状微丝骨架的生成来调控自噬溶酶体管化现象。综上所述,本次工作揭示了分枝状微丝骨架的生成是自噬溶酶体再生过程中的一个重要环节。这一发现不仅加深了人们对于自噬溶酶体再生机制的认识,也有助于理解细胞内普遍存在的分枝状微丝骨架参与的膜形变过程。
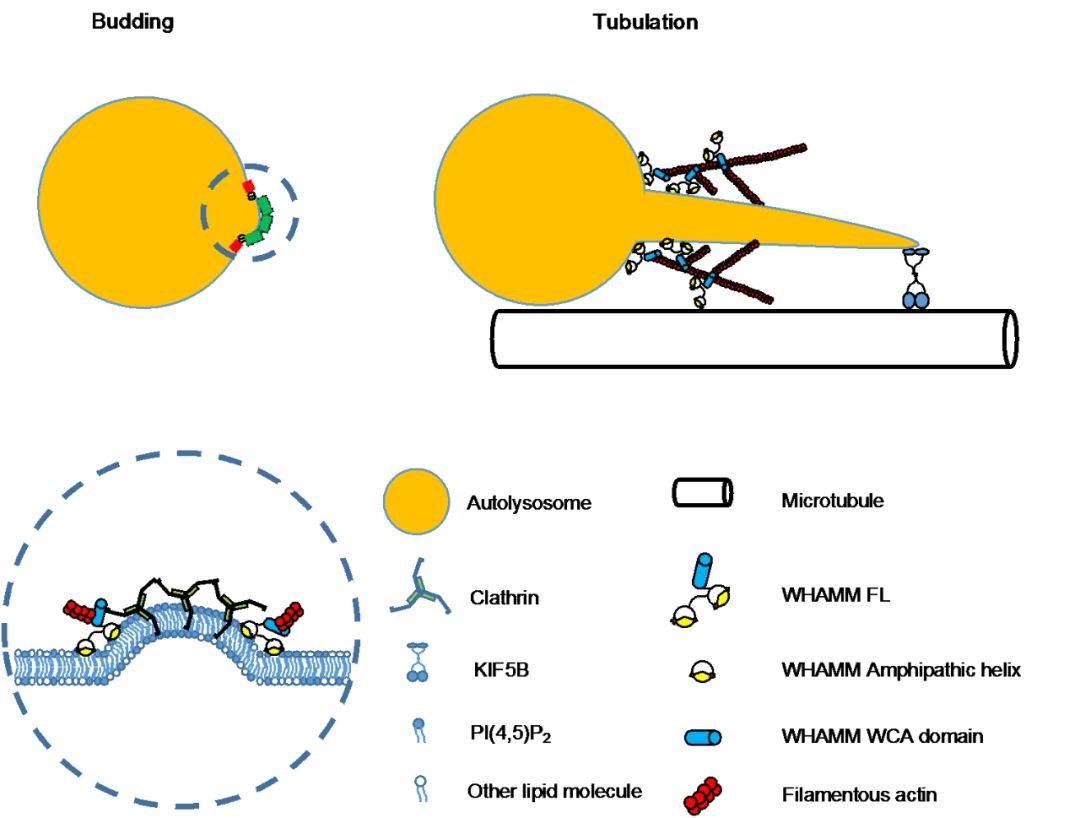
WHAMM调控自噬溶酶体管化的活细胞成像和作用模型
清华大学生命科学学院王宏伟教授和俞立教授为该论文的共同通讯作者。2013级生命学院博士生代安邦为该论文的第一作者。
原文链接:
https://doi.org/10.1038/s41467-019-11694-9
参考文献
1. Yu,L. et al. Termination of autophagyand reformation of lysosomes regulated by mTOR. Nature 465, 942-946(2010).
2. Rong, Y. et al. Clathrin and phosphatidylinositol-4,5-bisphosphate regulateautophagic lysosome reformation. NatureCell Biology 14, 924-934 (2012).
3. Du, W. et al. Kinesin 1 Drives Autolysosome Tubulation. Developmental Cell 37, 326-336 (2016).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474252&idx=5&sn=89fbcde8e123ce9a02815cc7a8a50f45&chksm=84e21838b395912e90d59871a8bfe29a4f251692229981ca62b0e568e0f9ef173a5100e281a7&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



