来源:BioArt
多系统蛋白病 (Multisystem proteinopathy, MSP)是一类遗传性疾病,其病症主要包含病理上相互关联的包涵体肌病(inclusion body myopathy, IBM)、肌萎缩侧索硬化 (amyotrophic lateral sclerosis, ALS,也称为“渐冻人症”)、额颞痴呆(frontotemporal dementia, FTD)。在这类遗传疾病群体中发现了大量的致病突变,这些突变主要分成两类:RNA结合蛋白(RNA-bindingprotein)和调节自噬的泛素结合蛋白(如VCP/p97, SQSTM1/p62和UBQLN2)。
MSP的主要病理特征包括细胞内泛素和RNA结合蛋白的聚集【1】。之前的研究表明RNA结合蛋白的突变能改变许多无膜细胞器(membranelessorganelle)比如应激颗粒(Stress Granule, SG)或者使某些RNA结合蛋白更加容易形成淀粉样纤维(amyloidlike fibril)【2】。这些沉积的应激颗粒可能是导致组织病变的一个重要因素。另一方面,自噬也可以清除细胞内的应激颗粒。
自噬(Autophagy)是一条高度保守的通路,调节这条通路最上游的分子是由ULK1/2,ATG13,RB1CC1和ATG101组成的ULK复合物(ULKcomplex)。ULK1/2是一类保守的丝氨酸/苏氨酸磷酸激酶,通过磷酸化一系列底物,比如ATG13,VPS34, BECN1, ATG14, 和SQSTM1来调节自噬。但是目前核心自噬相关蛋白对于应激颗粒动态的调节和其在IBM/ALS/FTD/MSP中的功能还不清楚。
近日,来自美国St. Jude儿童研究医院的Mondira Kundu课题组王波博士在Molcular Cell发表题为ULK1 and ULK2 Regulate Stree Granule Disassembly Through Phosphorylation and Activation of VCP/p97的研究,发现自噬诱导激酶ULK1/ULK2可以通过磷酸化VCP/p97完成对应激颗粒的解聚。

研究人员通过在小鼠肌肉组织里条件性敲除Ulk1和Ulk2发现ULK1/2的缺失导致跟IBM临床表现十分类似的表型,但是条件性敲除另一个关键的自噬基因Atg7产生的表型却完全不同。虽然在这两个小鼠模型里都有由于阻断自噬而导致的泛素和p62的聚集,但是在Ulk1/2条件敲除的小鼠里面,研究人员还发现了RNA结合蛋白在包涵体里面的聚集。这个发现让研究人员猜测也许ULK1/2也许还具有基于自噬以外的能够调节RNA结合蛋白代谢的功能。
为了研究这个表型的深层机制,研究人员利用质谱来鉴定ULK1/2的结合蛋白,加上已经发表的ULK1/2结合蛋白,研究人员整理出一个ULK1/2的相互作用组(interactome)。通路分析发现有两类显著聚集的蛋白:自噬相关的蛋白和RNA结合蛋白。如果说前者属于意料之中,那么后者完全属于意料之外。这个ULK1/2的interactome也跟研究人员在体内发现的表型相互吻合,让研究人员进一步推测可能ULK1/2还具有独立于自噬之外能够调节应激颗粒动态的功能。
接下来,研究人员利用CRISPR/Cas9在内源的Ulk1和Ulk2位点上knock-in3Xflag标签,然后确定ULK1/2在细胞内的定位。细胞经过在43°C热激处理(heatshock)以后,研究人员发现内源ULK1/2很明显的定位在应激颗粒上。为了确定ULK1/2在应激颗粒动态中的功能,研究人员采用了Ulk1/2DKO细胞系,Ulk1/2siRNA和ULK1/2抑制剂(SBI-0206965)等遗传和药物学手段证明了ULK1/2能够调节应激颗粒的去组装(disassembly),但是对应激颗粒的组装(assembly)没有明显影响。重要的是,不同于Ulk1/2,其他关键的自噬基因包括Atg7,Atg14,Atg13, Rb1cc1在研究人员的实验体系中对应激颗粒的去组装没有显著影响,证明ULK1/2在应激颗粒去组装过程中的调节功能是独立于自噬的。
为了进一步理解ULK1/2调节应激颗粒的生化机制,研究人员把目光投向了VCP这个蛋白,因为VCP是IBM中最常见的突变基因之一。利用免疫共沉淀,研究人员能够在组织和细胞里检测到ULK1/2和VCP的相互作用,并且ULK1/2和VCP的相互作用会随着应激(比如heatshock或者arsenite)而增强。利用体外激酶实验,研究人员发现ULK1/2可以磷酸化VCP。之后的体外实验和体内实验表明ULK1/2能够特异性地磷酸VCP的S13,S272,和T761。为了确定这些磷酸化的功能,研究人员生成了RNAi-resistantphospho-defective(3A)和phospho-mimetic(3D)的VCP突变,然后在细胞里面稳定表达这些VCP突变。结果发现,稳定表达VCPWT或者3D的细胞能够正常的去组装应激颗粒,而表达VCP3A的细胞不能正常的去组装应激颗粒。这些结果证明VCP的磷酸化对于促进应激颗粒的去组装有重要的功能。更为重要的是,研究人员利用了一个最近开发出来的ULK1/2的激动剂(LYN-1604),进一步表明ULK1/2的激动能够显著加速应激颗粒的去组装。
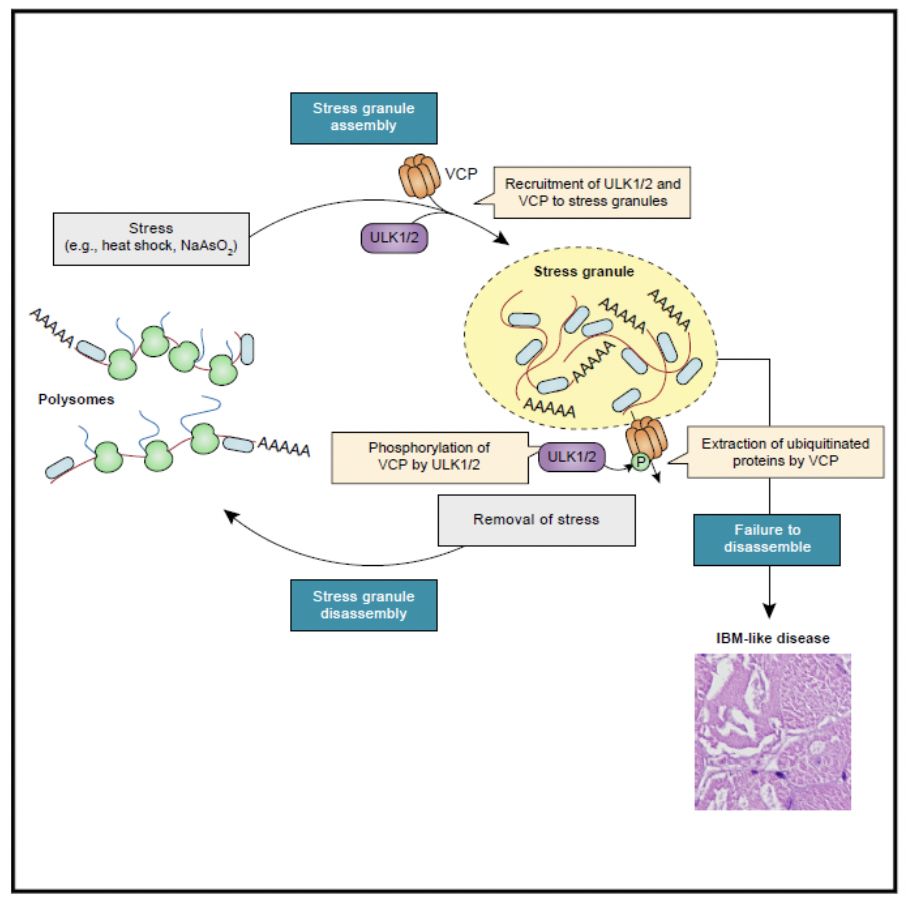
本研究表明,ULK1/2作为一个自噬诱导基因,还具有一些十分重要的独立于自噬的功能。研究人员鉴定了一个全新的ULK1/2的底物VCP,并且初步阐释了ULK1/2如何激活VCP并且促进应激颗粒去组装。由于ULK1/2是磷酸化激酶,而且目前这类激酶的抑制剂和激动剂都已经被开发出来了。未来也许可以利用这类激酶的激动剂来治疗IBM/ALS/FTD/MSP这一类致命性的疾病。
原文链接:
https://www.cell.com/molecular-cell/pdf/S1097-2765(19)30231-X
制版人:子阳
参考文献
1.Taylor,J.P. (2015). Multisystem proteinopathy: Intersecting genetics in muscle, bone,and brain degeneration. Neurology 85, 658–660.
2. Mackenzie,I.R., Nicholson, A.M., Sarkar, M., Messing, J., Purice, M.D., Pottier, C.,Annu, K., Baker, M., Perkerson, R.B., Kurti, A., et al. (2017). TIA1 mutationsin amyotrophic lateral sclerosis and frontotemporal dementia promote phaseseparation and alter stress granule dynamics. Neuron 95, 808–816.e809.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468840&idx=4&sn=0b0eb4542c2dedb586dcf956e9398165&chksm=84e2e5dcb3956cca913aa1914c475ad363c21cfdda3c25cd89e63b24acc9bd429de4fcdfc932&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



