来源:BioArt
基因编辑,可谓是生物医学领域的一项重大革命。从早期的锌指核酸酶(Zinc-finger nucleases, ZFNs)技术和转录激活因子样效应物核酸酶(Transcription activator-like effector nucleases, TALENs)技术,到具有划时代意义的CRISPR/Cas9系统的发现,再到如今炙手可热的单碱基编辑器,这些基因组编辑技术的飞速发展为科学研究的进步以及人类遗传疾病的治疗都带来了振奋人心的希望。
对于基因组编辑,我们希望有一种工具能够实现对任意靶标位点进行高效且唯一特异地编辑,不会产生任何非特异性的编辑。然而,自然界的演化由于其方向的不特定,不太可能存在这种理想的工具,更多地要靠人为筛选。
工程核酸酶可高效地进行基因编辑,然而其可能发生的脱靶效应仍然是人们最为担心的问题,尤其是将之应用于临床治疗时。传统的核酸酶改造策略主要将目光聚焦于靶点识别起始阶段,而少有对后续过程尤其是催化反应动力学的改造。而这,可能是一处可能会有意想不到良好表现的并且尚未开发的处女地。
2019年7月29日,处于ZFNs技术垄断地位的Sangamo Therapeutics 公司的科学家Edward J. Rebar,在Nature Biotechnology上发表文章Enhancing gene editing specificity by attenuating DNA cleavage kinetics,文章筛选ZFN蛋白FokI裂口结构域的单氨基酸残基突变体,通过降低剪切中心的催化活性,实现了脱靶率的大幅下降,并且运用改造后的ZFN蛋白在人T细胞中编辑破坏TRAC位点,实现了超过98%的编辑效率以及无可检测的脱靶活性。

作者观察到ZFN蛋白能够快速地在靶点位置和脱靶位置进行DNA剪切反应。于是作者提出一个假设,是否是由于DNA裂解反应过快导致ZFN蛋白无法区分在靶和脱靶位点呢?为了验证这个猜想,作者选取了裂解反应中心的FokI结构域进行了单氨基酸残基突变体筛选,以降低裂解反应的动力学常数,使k2远远小于任何脱靶位点的k-1。基于此策略,作者筛选到多个可以显著降低脱靶剪切率,同时保留相当程度(62-124%)反应活性的突变体。其中,效果最好的两个突变体(I479Q和Q481A)不仅具有完全的反应活性,而且脱靶剪切率降低了超过1000倍。全基因组范围内的脱靶情况分析表明,Q481A突变体完全地抑制了所有的脱靶位点(图一)。

图一. 突变体在全基因组范围降低脱靶位点裂解的发生
然而,某些ZFN蛋白的脱靶位点k-1本身就极其小,再通过降低k2的方式开发ZFNs可能就会影响其与目标序列的结合;另外,太高的非特异性序列结合能可能会使ZFN蛋白被大量基因组DNA隔离,导致难以与目标序列结合。因此,作者试图减少ZFN蛋白与非特异性DNA的亲和力。研究发现,锌指结构“-5”位置的精氨酸是其与非特异性DNA相互作用的关键氨基酸,将其替换为谷氨酰胺,可以加速锌指蛋白与DNA的解离达到50倍(图二)。
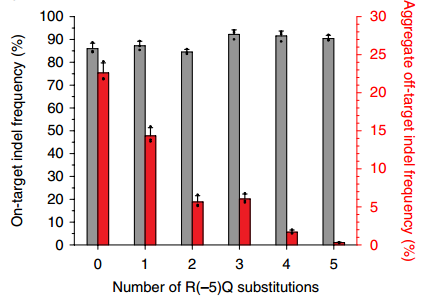
图二. R(-5)Q突变体降低了脱靶位点发生频率
最后,结合两种改造方式获得突变体ZFN,对肿瘤靶向T细胞的TRAC位点进行敲除。结果表明,其中表现最好的突变体(pair14和pair60)可以实现高效(98%)基因编辑,并且完全无可检测的脱靶位点活性(图三)。

图三. 突变体ZFN编辑TRAC位点后全基因组脱靶位点检测
简而言之,作者创造性地提出了工程改造核酸酶促进靶向性的新策略,即通过降低核酸酶剪切DNA序列过程的动力学常数,以及锌指结构(-5)位置与非特异性DNA结合亲和力,实现脱靶率的降低。运用这一策略,作者实现了对临床相关的TRAC位点的完全敲除,并且无可检测的脱靶位点。这份研究为高效、特异的基因组编辑工具的开发优化提供了全新的思路,大大促进了领域的发展。
原文链接:
https://doi.org/10.1038/s41587-019-0186-z
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652473743&idx=3&sn=91202a4b3ceea1adb12bb0fd6c6f9cc8&chksm=84e21a3bb395932d4da0e7901e46ed74d3d3e198eec8cb791b138aeeb70e1b5cf27c5ccc3784&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn




