来源:BioArt
肠道不仅是消化器官,也是大脑以外最为复杂的神经系统,被科学家们称为“第二大脑”,这个“大脑”可以通过一些介质如激素、代谢物等与其他器官之间进行交流,从而影响机体的生理机能和疾病发生,因此,在器官间信号传导的背景下,探索代谢物的指导潜能具有重要的意义。 然而,现如今,基础研究人员普遍认为,大多数哺乳动物的生理系统在两种性别上基本相同,因此,研究一种性别通常就足以理解组织功能和疾病的基本原理。但是,随着科学的发展,这种“性别歧视”正在被瓦解,人们意识到两性的生物学差异是在胚胎发育过程中由基因决定的,这些差异对个体的生理、生殖、心理和社会生活都有重大影响【1】。越来越多的研究表明男性和女性在生理和疾病易感性方面存在差异,性别差异不再仅仅是荷尔蒙水平上的差别这么肤浅,男性和女性似乎就是两套不同的生物学系统,而这之中,代谢稳态系统是由两性内在的不同生物学特性引起的具有相当显著差异的系统之一【2,3】。因此,越来越多的科学家开始呼吁研究中的性别平等,将关于性别差异的合理设计的实验整合到代谢学和其他领域的研究中将加速研究者对一些疾病和药物的发现,增强治疗疾病的能力【2】。 尽管如此,在基础研究和临床研究中考虑性别的现实压力告诉我们,性别差异是广泛存在的,却也是还未得到充分探索的。以哺乳动物或昆虫为对象的大量研究表明,两者存在的性别差异均是整合了内在和外在双重因素的复杂过程。果蝇的性染色体感应可以激活剪接级联反应,从而导致RNA结合蛋白TraF只在雌性果蝇中表达,进而导致转录因子Doublesex (Dsx)和Fruitless (Fru)在一个细胞亚群中发生性别特异性剪接,以形成解剖学特征、生殖系统和行为的性别差异,这也使得果蝇被广泛用于生物学中性别差异相关的研究。 与哺乳动物相似,成年果蝇的消化道是一个具有可塑性和功能区域化的器官,它含有与人类相似的微生物群和细胞类型,包括自我更新的上皮祖细胞、消化/吸收的肠上皮细胞(ECs)和分泌激素的肠内分泌细胞,这使得果蝇成为肠道研究的重要模型。已有研究利用果蝇模型揭示了肠道干细胞增殖存在性别差异,同时肠道内代谢基因的表达也存在性别差异,提示性别偏向的肠道代谢可能是导致全身生理机能性别差异的原因之一【4】。
2019年8月8日,来自英国伦敦帝国理工学院的Miguel-Aliaga研究团队在Cell上发表题为“Sex Differences in Intestinal Carbohydrate Metabolism Promote Food Intake and Sperm Maturation”的文章,以黑腹果蝇为实验对象,揭示了肠道中糖代谢存在性别差异,只有雄性果蝇性腺与邻近肠道区域之间存在双向交流,并且这种沟通通过细胞因子信号和代谢产物柠檬酸的介导影响了肠道和睾丸的功能。 已有研究发现,沿着动物胃肠道的不同区域存在着基因表达差异【5】,提示肠道功能的区域专门化。基于此,本文的研究者通过对成年雄性和雌性果蝇的肠道基因进行测序,并用绿色荧光蛋白(GFP)标记肠道内相应蛋白进行分析,结果显示成年果蝇肠道中调控糖代谢的蛋白质的表达存在雄性偏倚,并且这种肠道性别差异在空间上局限于后部R4中肠区域。
已有研究发现,沿着动物胃肠道的不同区域存在着基因表达差异【5】,提示肠道功能的区域专门化。基于此,本文的研究者通过对成年雄性和雌性果蝇的肠道基因进行测序,并用绿色荧光蛋白(GFP)标记肠道内相应蛋白进行分析,结果显示成年果蝇肠道中调控糖代谢的蛋白质的表达存在雄性偏倚,并且这种肠道性别差异在空间上局限于后部R4中肠区域。
 已有研究发现,沿着动物胃肠道的不同区域存在着基因表达差异【5】,提示肠道功能的区域专门化。基于此,本文的研究者通过对成年雄性和雌性果蝇的肠道基因进行测序,并用绿色荧光蛋白(GFP)标记肠道内相应蛋白进行分析,结果显示成年果蝇肠道中调控糖代谢的蛋白质的表达存在雄性偏倚,并且这种肠道性别差异在空间上局限于后部R4中肠区域。
已有研究发现,沿着动物胃肠道的不同区域存在着基因表达差异【5】,提示肠道功能的区域专门化。基于此,本文的研究者通过对成年雄性和雌性果蝇的肠道基因进行测序,并用绿色荧光蛋白(GFP)标记肠道内相应蛋白进行分析,结果显示成年果蝇肠道中调控糖代谢的蛋白质的表达存在雄性偏倚,并且这种肠道性别差异在空间上局限于后部R4中肠区域。进一步地实验表明,肠道糖基因表达的性别差异由性腺的性别控制着,并且以来自雄性性腺的信号作为分子媒介的,而与其他器官无关。 基于以上发现,本文研究人员推测,雄性性腺以一种性别差异的方式激活肠道细胞中的某一信号通路,从而导致糖基因的雄性偏向表达。为了找到这一通路,实验人员通过敲除ECs中的信号转导成分进行了基因筛选,结果表明雄性性腺在ECs的一个亚群中促进空间受限的JAK-STAT信号通路激活,导致在特定的中肠部分出现偏向雄性的肠道糖基因表达,从而揭示了雄性性腺和肠道之间的器官间通讯过程。
到此,我们不禁想问,肠道与雄性性腺之间的这种独特的交流对于果蝇来说有什么作用呢?这种作用又是怎么产生的呢?通过进一步的实验,本文研究人员向我们呈现了一个“交流”模式,即肠上皮细胞R4区域的偏向雄性的JAK-STAT信号通路的激活上调了肠道糖基因的表达,从而产生胞质柠檬酸盐,后者通过柠檬酸盐转运体Indy被运输至体循环中,以促进食物摄入。与此同时,肠道柠檬酸盐也可以通过Indy转运体从R4中肠区域局部转移到邻近的睾丸,以维持着雄性配子的成熟。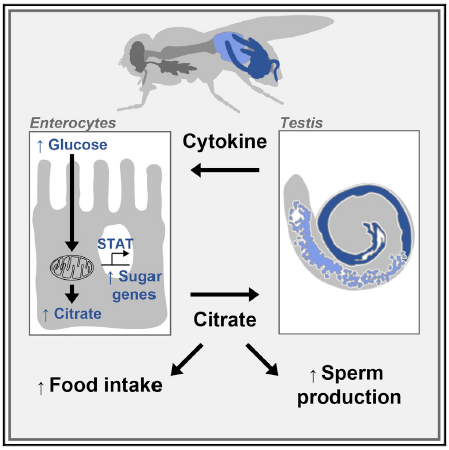 综上所述,本文阐述了肠道-性腺的双向交流,即雄性性腺与特定肠道区域进行交流,促进其细胞因子信号通路JAK-STAT的激活以分泌柠檬酸盐,从而促进食物的摄入;同时肠道来源的柠檬酸盐反过来进入邻近的睾丸,以促进雄性配子的成熟。本研究为糖代谢的区域特异性和细胞类型特异性提供了有利证据,同时,不同性别的肠道糖代谢的不同,也说明性别差异可以局限于特定的器官部分,更有甚者,即使一些消化酶在中肠表达广泛,其雄性差异也是后部R4中肠区域特有的,从而表明特定的肠道部分可能在生理上被“性别化”,以满足生殖需求——在本例中是精子生成,以此也提示我们性别差异在基础和临床研究中的不可忽视性,在两种性别的细胞和动物上进行实验有时是必须的。
综上所述,本文阐述了肠道-性腺的双向交流,即雄性性腺与特定肠道区域进行交流,促进其细胞因子信号通路JAK-STAT的激活以分泌柠檬酸盐,从而促进食物的摄入;同时肠道来源的柠檬酸盐反过来进入邻近的睾丸,以促进雄性配子的成熟。本研究为糖代谢的区域特异性和细胞类型特异性提供了有利证据,同时,不同性别的肠道糖代谢的不同,也说明性别差异可以局限于特定的器官部分,更有甚者,即使一些消化酶在中肠表达广泛,其雄性差异也是后部R4中肠区域特有的,从而表明特定的肠道部分可能在生理上被“性别化”,以满足生殖需求——在本例中是精子生成,以此也提示我们性别差异在基础和临床研究中的不可忽视性,在两种性别的细胞和动物上进行实验有时是必须的。
 综上所述,本文阐述了肠道-性腺的双向交流,即雄性性腺与特定肠道区域进行交流,促进其细胞因子信号通路JAK-STAT的激活以分泌柠檬酸盐,从而促进食物的摄入;同时肠道来源的柠檬酸盐反过来进入邻近的睾丸,以促进雄性配子的成熟。本研究为糖代谢的区域特异性和细胞类型特异性提供了有利证据,同时,不同性别的肠道糖代谢的不同,也说明性别差异可以局限于特定的器官部分,更有甚者,即使一些消化酶在中肠表达广泛,其雄性差异也是后部R4中肠区域特有的,从而表明特定的肠道部分可能在生理上被“性别化”,以满足生殖需求——在本例中是精子生成,以此也提示我们性别差异在基础和临床研究中的不可忽视性,在两种性别的细胞和动物上进行实验有时是必须的。
综上所述,本文阐述了肠道-性腺的双向交流,即雄性性腺与特定肠道区域进行交流,促进其细胞因子信号通路JAK-STAT的激活以分泌柠檬酸盐,从而促进食物的摄入;同时肠道来源的柠檬酸盐反过来进入邻近的睾丸,以促进雄性配子的成熟。本研究为糖代谢的区域特异性和细胞类型特异性提供了有利证据,同时,不同性别的肠道糖代谢的不同,也说明性别差异可以局限于特定的器官部分,更有甚者,即使一些消化酶在中肠表达广泛,其雄性差异也是后部R4中肠区域特有的,从而表明特定的肠道部分可能在生理上被“性别化”,以满足生殖需求——在本例中是精子生成,以此也提示我们性别差异在基础和临床研究中的不可忽视性,在两种性别的细胞和动物上进行实验有时是必须的。 原文链接:https://doi.org/10.1016/j.cell.2019.07.02
参考文献
1. Arnold AP,Chen X, Link JC, Itoh Y, Reue K. Cell-autonomous sex determination outside ofthe gonad.Dev Dyn. 2013;242:371–9.2.Mauvais-Jarvis F, Arnold AP, Reue K. A Guide for the Design of Pre-clinicalStudies on Sex Differences in Metabolism. Cell Metabolism. 2017 Jun6;25(6):1216-1230.3. Link, J.C.,Hasin-Brumshtein, Y., Cantor, R.M., Chen, X., Arnold, A.P., Lusis, A.J., andReue, K. (2017). Diet, gonadal sex, and sex chromosome complement influencewhite adipose tissue miRNA expression.BMC Genomics18, 89.4. Hudry, B.,Khadayate, S., and Miguel-Aliaga, I. (2016). The sexual identity of adultintestinal stem cells controls organ size and plasticity. Nature 530, 344–348.5. Bates, M.D.,Erwin, C.R., Sanford, L.P., Wiginton, D., Bezerra, J.A., Schatzman, L.C.,Jegga, A.G., Ley-Ebert, C., Williams, S.S., Steinbrecher, K.A., et al. (2002).Novel genes and functional relationships in the adult mouse gastrointestinaltract identified by microarray analysis. Gastroenterology 122, 1467–1482.来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652473700&idx=3&sn=e124b67cdf8ff094a5e22c5998414cc0&chksm=84e21ad0b39593c60dd72c17bd6a1e14470d878f452ba881dbcfe21b20818d1fbefd0ddc2837&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn