来源:BioArt
细胞进入有丝分裂阶段,中心体(centrosome)负责催化组装纺锤体所需微管的形成。受到丝氨酸/苏氨酸蛋白激酶PLK4的调控,中心体自身在每个细胞周期仅复制一次。有研究表明,即使抑制PLK4活性,许多癌细胞和正常细胞细胞分裂仍可在无中心体复制的条件下进行,产生无中心体的细胞,然而这些细胞表现出延迟的非中心体型纺锤体组装(acentrosomal spindle assembly)【1】。截至目前,人们对这一非经典组装方式知之甚少。为了探索中心体生物学功能以及PLK4抑制作为癌症疗法的潜力,先前已开发出具有选择性的和细胞活性的PLK4抑制剂(centrinone)【1,2】。经centrinone处理的缺乏中心体的细胞虽能形成双极纺锤体,但纺锤体组装及染色体排列进程均被延迟且出错频率明显增加。因此,通过抑制PLK4对中心体复制的调控作用,附加对非中心体型纺锤体组装途径的干扰,将不失为阻断癌细胞增殖的新策略。
2020年9月9日,Nature杂志接连发表两篇文章,来自美国和英国的不同课题组非常默契的共同揭示出TRIM37在细胞有丝分裂中的调控作用,以及PLK4抑制剂对于治疗TRIM37高扩增肿瘤的潜力。
其中一篇为来自美国的路德维希癌症研究所的Arshad Desai课题组与Karen Oegema课题组合作发表的题为“TRIM37 controls cancer-specific vulnerability to PLK4 inhibition”的文章【3】,该研究发现不同表达水平的TRIM37可以通过截然不同的机制控制细胞内非中心体型纺锤体的组装,以分别达到改善PLK4抑制后的细胞增殖或诱导有丝分裂失败及增殖停滞的结果。

先前通过全基因组筛选,已鉴定出泛素连接酶TRIM37的失活可以使经centrinone处理的RPE1细胞仍持续增殖【4】。作者进一步确认TRIM37的缺失不会改变具有中心体的细胞有丝分裂持续时间(用DMSO处理),但确实可以挽救在缺乏中心体的细胞中观察到的延迟的纺锤体组装和染色体分离失败的情况(用centrinone处理)。相反,过表达TRIM37会显着增加经centrinone处理的细胞有丝分裂持续时间并加重染色体分离失败情况,即有丝分裂缺陷程度与TRIM37含量成正比。因此,上述结果可以得出初步结论:PLK4抑制后由中心体缺失引起的有丝分裂受影响程度以双向方式取决于TRIM37,TRIM37的缺失可以改善结局,而TRIM37的增加却使结局恶化。
值得注意的是,TRIM37基因座位于17q22和17q23的边界,这是在许多癌症中扩增的染色体区域,最显着的是约50-60%的神经母细胞瘤和大约10%的乳腺癌病例【5-8】。随后,作者通过分析存在TRIM37扩增的六种癌细胞系及四种TRIM37未扩增的癌细胞系,发现六种具有高TRIM37水平的癌细胞系无法在centrinone处理后增殖,提示TRIM37与PLK4抑制存在合成致死性(Synthetic lethality)。
那么,究竟是什么原因导致不同表达水平的TRIM37将细胞非中心体型有丝分裂引向相反命运呢?作者在研究中发现TRIM37可以阻止PLK4自组装为凝聚体(condensate),该凝聚体可以募集其他中心体成分并充当异位微管成核中心(ectopic microtubule-nucleating centre)。此外,作者通过原位荧光标记中心体蛋白CEP192(多功能骨架蛋白,可与PLK4结合调控中心体复制,与PLK1和Aurora A结合调控中心粒外周物质的组装),观察到在PLK4受到抑制的细胞中,升高的TRIM37水平抑制了非中心体型有丝分裂灶点(acentrosomal mitotic foci)的形成。TRIM37是一个三重基序泛素连接酶,尚未报道其中心体定位。作者在此项研究中发现CEP192的495个氨基酸的羧基末端区域可以牢固地与TRIM37结合,以TRIM37依赖方式泛素化并降解。这些数据表明,PLK4和CEP192均为直接的TRIM37靶标。然而,与PLK4不同,CEP192蛋白水平受TRIM37连接酶活性的控制,尤其是在中心体缺失的情况下。因此,TRIM37水平升高通过引起CEP192降解而赋予细胞对PLK4抑制的敏感性,从而阻断非中心体型有丝分裂灶点的形成并加重细胞生长停滞的情况。
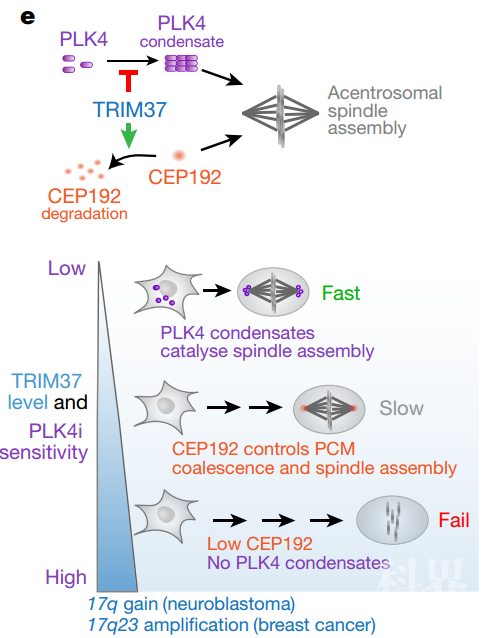 图1,抑制PLK4后TRIM37对非中心体型有丝分裂进行双向控制的模型
图1,抑制PLK4后TRIM37对非中心体型有丝分裂进行双向控制的模型最后,由于centrinone的药代动力学特征阻止了其在肿瘤模型中的使用,作者通过使用两个CHP134 PLK4 shRNA克隆在裸鼠中产生异种移植瘤,并切换饲料以诱导shRNA表达(CHP134,一种TRIM37扩增的神经母细胞瘤细胞系)。结果显示,PLK4 shRNA诱导抑制了两个克隆的肿瘤生长。因此,这一异种移植肿瘤实验凸显了抑制PLK4作为神经母细胞瘤以及具有高TRIM37表达的其他癌症新型治疗策略的潜力。
另一篇为来自英国牛津大学威瑟尔分子医学研究所的J. Ross Chapman课题组和来自美国约翰霍普金斯大学分子生物学和遗传学系的Andrew J. Holland课题组合作发表的题为“Targeting TRIM37-driven centrosome dysfunction in 17q23-amplified breast cancer”的文章【9】,该研究类似地揭示了TRIM37在中心体缺失的情况下,对非中心体型有丝分裂机制的调节作用,也强调了TRIM37高表达与PLK4抑制的合成致死作用在乳腺癌治疗中的潜力。

作者首先发现含有17q23乳腺癌扩增子的MCF-7细胞在用centrinone处理后出现进行性的中心体损失,并在17q23扩增子内的大约40个蛋白质编码基因中筛选出先前被报道与中心体功能相关的基因TRIM37。通过shRNA阻断TRIM37的表达后,经centrinone处理的细胞细胞生长;在对中心体丢失不敏感的人结肠直肠癌细胞系HCT116中过表达TRIM37,用centrinone处理后细胞存活率降低再次证明TRIM37升高可增强细胞对PLK4抑制的敏感性。随后,使用centrinone(抑制PLK4),CFI-400945(抑制PLK4和Aurora B)和ZM447439(抑制Aurora B)处理MCF-7均能有效降低细胞存活率,当然,TRIM37耗竭仅恢复了用centrinone处理的细胞增殖,无法恢复用CFI-400945或ZM447439处理的细胞的增殖情况,表明针对PLK4(而非其他激酶)的抑制剂选择性对于过表达TRIM37细胞的合成致死作用至关重要。
与上篇研究类似地,作者也通过测试centrinone对TRIM37正常表达或扩增的不同乳腺癌细胞的增值情况,证实PLK4抑制剂处理的合成致死作用取决于TRIM37的含量。与此同时,作者测试了源自乳腺癌患者(分别具有不同TRIM37 mRNA水平)的3D类器官培养物(3D organoid cultures)对centrinone的敏感性。结果显示敏感性的分布与在乳腺癌细胞系中得出的结论一致。因此,上述细胞系和患者来源的类器官实验均强调了PLK4特异性抑制剂在杀死TRIM37扩增的乳腺癌细胞中的效用。
随后,这篇文章的作者也观察到TRIM37耗竭恢复了在Centrinone处理的MCF-7细胞中稳定的双极纺锤体形成,并通过免疫共沉淀证实了TRIM37和CEP192的相互作用,并通过TRIM37的无催化活性(C18R),泛素结合及转移缺陷(R67A)的RING结构域突变体都不会降低包含CEP192在内的中心粒外周物质(pericentriolar material,PCM)的蛋白水平,证实TRIM37通过泛素-蛋白酶体途径指导这些蛋白的降解,从而影响非中心体型PCM灶点的形成,而这些灶点在缺乏中心体的细胞中,对于有效的微管成核和坚固的双极纺锤体组装是必需的。
最后,作者更详细的展示了TRIM37在细胞有丝分裂过程中对中心体成熟的延时影响:如MCF-7细胞中的TRIM37耗竭在G2期后期加速了中心体成熟20分钟,并在进入有丝分裂时加快了中心体分离;相反,RPE-1细胞中的TRIM37过表达将G2期后期的中心体成熟延迟了17分钟。这些数据表明,TRIM37升高驱动的PCM组装抑制在G2期晚期延迟了微管成核和中心体分离。
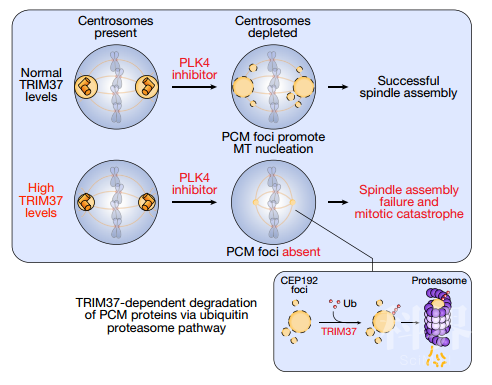 图2,17q23扩增的乳腺癌细胞中PLM4抑制与TRIM37过表达的合成致死作用模型
图2,17q23扩增的乳腺癌细胞中PLM4抑制与TRIM37过表达的合成致死作用模型综上所述,两篇文章均提出了PLK4抑制作用下,TRIM37担任控制细胞分裂的“变阻器”(rheostat)的作用。伴随TRIM37扩增的中心体缺陷可能加剧随机的有丝分裂错误,从而导致伴随17q23扩增的癌症中存在基因组不稳定的高负担,并可能推动肿瘤的发展。因而,通过抑制PLK4或其他中心体复制或组装调节剂,可能代表一种有前途的治疗策略,可选择性地靶向17q23扩增驱动的乳腺癌或其他肿瘤(如神经母细胞瘤)。
参考文献
1, Wong, Y. L. et al. Reversible centriole depletion with an inhibitor of Polo-like kinase 4. Science 348, 1155–1160 (2015).
2, Oegema, K., Davis, R. L., Lara-Gonzalez, P., Desai, A. & Shiau, A. K. CFI-400945 is not a selective cellular PLK4 inhibitor. Proc. Natl Acad. Sci. USA 115, E10808–E10809 (2018).
3, TRIM37 controls cancer-specific vulnerability to PLK4 inhibition.
4, Meitinger, F. et al. 53BP1 and USP28 mediate p53 activation and G1 arrest after centrosome loss or extended mitotic duration. J. Cell Biol. 214, 155–166 (2016).
5, Bulavin, D. V. et al. Amplification of PPM1D in human tumors abrogates p53
tumor-suppressor activity. Nat. Genet. 31, 210–215 (2002).
6, Ho, N. et al. Delineation of the frequency and boundary of chromosomal copy number variations in paediatric neuroblastoma. Cell Cycle 17, 749–758 (2018).
7, Li, J. et al. Oncogenic properties of PPM1D located within a breast cancer amplification epicenter at 17q23. Nat. Genet. 31, 133–134 (2002).
8, Liu, Y. et al. Targeting 17q23 amplicon to overcome the resistance to anti-HER2 therapy in HER2+ breast cancer. Nat. Commun. 9, 4718 (2018).
9, Targeting TRIM37-driven centrosome dysfunction in 17q23-amplified breast cancer.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652499070&idx=4&sn=ab6cf4a71791a8efd8fb31adf9035202&chksm=84e27fcab395f6dc59523f0c0644974b441db427e9d4004e6eeb68a3a8084a719ea12f5be1d9&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



