来源:中国医学科学院医学信息研究所
恶性肿瘤是严重威胁人类生命的疾病之一。对于多数恶性肿瘤患者而言,可采用化疗、放射疗法及生物免疫治疗等方法来杀死大部分肿瘤细胞,但是却无法从根本上治愈肿瘤。
肿瘤干细胞(Cancer Stem Cell,CSC),也被称作癌干细胞,或癌症干细胞,是指肿瘤中具有自我更新能力并能产生异质性肿瘤细胞的细胞。现在已经很清楚肿瘤干细胞在肿瘤恶化和产生治疗抗性中起了重要作用,最突出的表现在血液系统癌症如白血病中。因此,有学 者提出了肿瘤干细胞在肿瘤发生、发展、转移过程中都有重要作用,但到底什么是肿瘤干细胞现在尚无准确定义。
肿瘤干细胞和肿瘤组织细胞不同。这些细胞自身分化较慢,但对很多物理化学损伤(如放疗和化疗)耐受。据说化疗和放疗还能促进肿瘤干细胞的增殖。肿 瘤干细胞被认为是肿瘤治疗复发的根源,因为即使多数肿瘤细胞被杀死,只要肿瘤干细胞还在,根据定义这些干细胞可以分化成肿瘤细胞。这一理论为我们重新认识肿瘤的起源和本质,以及临床肿瘤治疗提供了新的方向和视觉角度。近年来肿瘤干细胞学说受到越来越多人的关注,并在乳腺癌、脑肿瘤、前列腺癌、肺癌、肝癌、结直肠癌、皮肤癌等多种恶性肿瘤中都成功分离出了肿瘤干细胞。基于此,小编针对肿瘤干细胞的研究进行一番梳理,以飨读者。
Cell:通过构建胰腺癌干细胞分子依赖性图谱,揭示胰腺癌治疗新策略doi:10.1016/j.cell.2019.03.010在一项新的研究中,来自美国加州大学圣地亚哥分校等研究机构的研究人员通过使用RNA测序(RNA-seq)、染色质免疫沉淀测序(ChIP-seq)和全基因组CRISPR分析来绘制胰腺癌干细胞的分子依赖性图谱,其中胰腺癌干细胞是优先驱动肿瘤发生和进展的高度治疗抵抗性细胞。相关研究结果发表在2019年4月18日的Cell期刊上,论文标题为“A Multiscale Map of the Stem Cell State in Pancreatic Adenocparcinoma”。
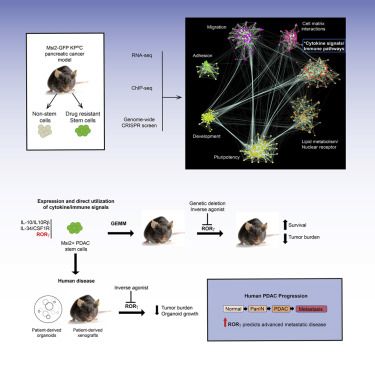 图片来自Cell, 2019, doi:10.1016/j.cell.2019.03.010。
图片来自Cell, 2019, doi:10.1016/j.cell.2019.03.010。
这种整合的基因组方法揭示了胰腺癌上皮细胞对免疫调节信号的意外利用。特别是,已知能促进炎症和T细胞分化的细胞核激素受体RORγ(retinoic-acid-receptor-related orphan receptor gamma, 视黄酸受体相关孤儿受体γ)在胰腺癌进展过程中被上调,而且针对 它的遗传抑制和药物抑制都会导致胰腺癌生长出现严重缺陷和生存率的显著提高。此外,对患者进行的大规模回顾性分析显示,RORγ表达可能预测胰腺癌的侵袭性,这是因为它与晚期疾病和癌症转移呈正相关。
PNAS:发现可高效杀伤脑胶质瘤干细胞的药物doi:10.1073/pnas.1816626116斯克里普斯研究所(TSRI)的科学家已经发现了一种化合物可以高效选择性杀伤脑胶质瘤干细胞,而正是这群细胞使得脑胶质瘤如此致命。这项研究于近日发表在《PNAS》上,来自TSRI的科学家发现一种被他们命名为RIPGBM的化合物可以杀伤病人肿瘤来源的脑胶质瘤干 细胞,杀伤效果是现在脑胶质瘤标准治疗药物替莫唑胺的40倍。他们还发现RIPGBM具有高度选择性,不会杀伤其他种类的脑细胞,同时可以显著抑制小鼠身上的脑胶质瘤的生长。过去的研究已经发现脑胶质瘤干细胞(glioblastoma cancer stem cells,GBM CSCs)是这种肿瘤如此致命的关键所在。GBM CSCs对于化疗和放疗具有很强的耐受性,会从原发瘤迁移到周围健康的大脑组织中。就算是手术切除肿瘤组织并进行标准化疗和放疗以后,仍然 会有一些GBM CSCs残留在病人大脑中,最终会生成新的肿瘤。Lairson及其同事设计了一种自动高通量筛选的方法对大量的小分子化合物进行了筛选,用它们处理健康脑细胞以及来自GBM病人肿瘤的GBM CSCs。“这些来自病人的细胞维持了肿瘤细胞致命的特点,包括注射进小鼠大脑中形成GBM样肿瘤的能力。”Lairson说道。经过几轮的筛选后,Lairson及其同事发现了化合物RIPGBM,它既可以高效杀伤GBM CSCs,又不会损伤正常脑细胞。”他们发现它之所以具有这种选择性是因为它会被GBM CSCs中一些特异性的酶或者因子修饰。在这些肿瘤细胞中,修饰后的cRIPGBM会诱发细胞凋亡。他们随后发现移植病人来源的胶质瘤细胞后,小鼠会在5周之内形成很大的脑瘤,而RIPGBM治疗的小鼠只能形成很小的脑瘤 。Lairson及其同事计划进一步开发RIPGBM,如果进展能顺利将会进行更多的动物实验和人体临床实验。
Cell Rep:靶向作用干细胞样细胞有望抑制卵巢癌复发doi:10.1016/j.celrep.2019.02.032卵巢癌并不是一种最常见的癌症类型,但其却属于致死性最高的一类癌症,其复发率大约为70%,近日一项刊登在国际杂志Cell Reports上的研究报告中,来自匹兹堡大学等多个机构的科学家们通过研究成功利用一种新型药物杀灭干细胞样的卵巢癌细胞,从而就有效遏制 了卵巢癌的复发。 文章中研究者发现,一种名为673A的新型实验性药物或能特异性地杀灭干细胞样细胞,这类细胞常常会在患者化疗后逗留;在卵巢癌小鼠模型中,将673A与化疗手段相结合或能明显改善癌症小鼠的生存率。医学博士Ronald Buckanovich说道,我们可以将干细胞样细胞想 象为种子,其会生根发芽长成植物,当我们在治疗癌症时实际上类似于“修剪草坪”,但问题是蒲公英总会回来的。化疗会杀灭90%-99%的癌细胞,但干细胞样细胞会躲过化疗从而使得患者癌症复发,通常11个干细胞样的细胞就能够形成肿瘤,相比之下,移植5万个非干细胞样癌细胞而其无法形成肿瘤却是可能的,研究者指出,实验性药物673A能够通过靶向作用ALDH信号通路来杀灭这 些干细胞样细胞,这些细胞会依赖于该通路来清除快速繁殖所产生的废弃物。利用673A来治疗卵巢癌仅能杀灭大约3%-5%的癌细胞,但由于这些细胞是干细胞样细胞,治疗的结果只能是给其重重的一拳。研究者表示,将人类卵巢癌细胞注射到小鼠机体后,给予其化疗和673A联合疗法,其中60%的小鼠在6个月治疗后痊愈了,而仅接受化疗的小鼠却仅有10%的发生了痊愈。研究者发现,673A仅能有效抵御对化疗耐受性的肿瘤,当将673A和化疗结合起来治疗癌症小鼠时,几乎 三分之二的小鼠在6个月病情发生了缓解,相比之下,仅接受化疗的小鼠会在同一时间段内死亡。由于卵巢癌通常会对化疗产生耐受性,而实验性药物673A能够潜在改善卵巢癌患者的死亡率;研究者Buckanovich表示,在673A上市之前还需要进行更多验证性工作,目前该药物在机体中停留时间较短,而且还需要更好的溶解性,而且该药物也没有在人类机体中进行测试 ;相比此前使用的ALDH抑制剂而言,673A杀灭干细胞样细胞的有效性是前者的10倍,而且其还能有效提高化疗的效果。
Cell:揭示高脂肪饮食促进结直肠癌产生机制doi:10.1016/j.cell.2019.01.036在一项新的研究中,来自美国沙克生物研究所的研究人员指出高脂肪膳食通过扰乱肠道中的胆汁酸平衡和触发一种潜在地让癌细胞茁壮成长的激素信号来促进结直肠癌生长。这些发现可能解释了需要几十年才能形成的结直肠癌,在一个高脂肪膳食普遍存在的时代,却出现在年轻人身上。相关研究结果发表在2019年2月21日的Cell期刊上,论文标题为“FXR Regulates Intestinal Cancer Stem Cell Proliferation”。
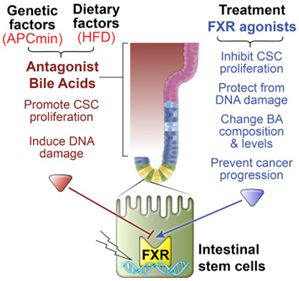 图片来自Cell, doi:10.1016/j.cell.2019.01.036。
图片来自Cell, doi:10.1016/j.cell.2019.01.036。
这项以小鼠模型为研究对象的研究展示了生活方式和遗传学如何相互影响。这些研究人员发现携带一种APC基因突变的动物当摄入高脂肪膳食时更快地患上癌症,其中这种APC基因突变是在结直肠癌患者中发现的一种最为常见的基因突变。论文共同通讯作者、沙克生物研究所基因表达实验室主任Ronald Evans教授说道,“这项研究提供了一种新的方法来降低炎症、恢复肠道健康和显著减少肿瘤进展。”
JCI:维生素C可以抑制肿瘤干细胞的产生!doi:10.1172/JCI121685近日一项由大连医科大学、中山大学等单位完成的发表在《Journal of Clinical Investigation》上的研究揭开了其中的秘密:压力荷尔蒙肾上腺素引发了一系列生物化学反应,导致了癌细胞生长和转移。在这项研究中研究人员首先展示了慢性压力对肿癌干细胞生长的 影响,这是此前研究没有关注的地方。研究人员使用了一种免疫缺陷的小鼠模型,结果发现慢性压力诱导的肾上腺素会促进乳腺癌细胞产生出癌干细胞样的性质,主要通过重置依赖乳酸脱氢酶(lactate dehydrogenase A,ALDHA)的代谢途径来完成。慢性压力诱导的肾上腺素会激活LDHA去产生乳酸从而改变pH,pH改变会导致USP28介导的的MYC的去泛素化从而增强其稳定性。SLUG增强子随后被MYC激活,这将促使癌细胞产生乳腺癌干细胞样的性质。利用靶向LDHA的药物筛查测试,研究人员发现维生素C可以逆转慢性压力诱导的一种干细胞样特征。这些发现表明了生理因素在促进乳腺癌细胞产生干细胞样的性质的过程中的重要性。因此,可以抑制LDHA的维生素C可能是对抗压力相关的乳腺癌的一种有效药物。
Genes & Devel:揭秘乳腺癌细胞可塑性产生的分子机制doi:doi:10.1101/gad.319889.118目前治疗乳腺癌的一大障碍就是癌细胞会不断改变方式来对疗法产生耐受性,理解介导癌细胞可塑性的细胞机制或能帮助开发新型的乳腺癌疗法;近日,一项刊登在国际杂志Genes & Development上的研究报告中,来自贝勒医学院的科学家们通过研究发现,乳腺癌细胞或 能在两种形式的细胞表面分子之间移动,即CD44分子—CD44s和CD44v;主要表达CD44s的乳腺癌细胞会增加转移的行为及对疗法的耐受性,而主要表达CD44v的癌细胞则会增加癌细胞的增殖特性。 研究者Chonghui Cheng说道,我们的目标是理解促进乳腺癌细胞变得异质性的分子机制,异质性是癌细胞难以治疗的一种原因;文章中,研究人员对乳腺癌干细胞进行了深入研究,这类细胞能够产生不同特性的细胞,而这种特性主要表现在细胞表面分子CD44上。CD44是 癌症干细胞的一种已知标志物,CD44基因能通过选择性剪接的方式产生CD44s和CD44v两种蛋白,研究者调查了这两种分子在乳腺癌细胞中表达的差异型,他们想知道是否不同形式的CD44分子会引发不同的疾病结果。文章中,研究者发现,在乳腺癌中,CD44s和CD44v两种CD44分子具有不同的生物学功能,乳腺癌细胞能利用不同形式的CD44分子,同时还能在两种CD44分子之间不断转换,表达高水平CD44s的癌细胞具有癌症干细胞的特性,其更趋向于具有转移性或复发性,而且能对疗法 产生耐受性;而当其转换到表达CD44v时,其就会携带较少的癌症干细胞特性,但却会增加癌细胞的增殖特性,选择性剪接是一种促进CD44分子转换的特殊机制。研究者表示,通过操控两种CD44分子的水平或许就能改变癌细胞的特性,从而增加癌细胞对疗法的敏感性。最后研究者Cheng说道,我们推测,或许还有其它基因也会经历选择性剪接的过程从而改变细胞的命运,同时或许还会改变细胞的可塑性从而引发癌症异质性的发生 。
PNAS:揭示蛋白JAG1在癌症干细胞分化和转移中起关键作用doi:10.1073/pnas.1815345116在一项新的研究中,来自美国莱斯大学和杜克大学的研究人员发现发现一种较小的蛋白--- JAG1---似乎在癌症干细胞如何发生分化和转移中发挥着关键性作用。至关重要的是,他们发现JAG1与在调节细胞命运中起着至关重要作用的Notch信号通路相互作用。相关研究结果发表在2019年1月2日的PNAS期刊上。
图片来自CC0 Public Domain。
上皮细胞形成排列在器官外表面的组织。间充质细胞是通常参与伤口修复等过程的迁移性细胞。上皮-间质转化(epithelial-mesenchymal transition, EMT)是一个将上皮细胞转化成迁移性的间充质细胞的过程。癌症劫持了这一过程,并通过让它停止在中间阶段而形 成转移性的杂合细胞而变得最具侵袭性。莱斯大学的研究人员之前已针对癌症干细胞如何通过控制参与胞外信号转导、伤口愈合和胚胎发育的Notch信号通路而在彼此之间和与外部世界之间进行通信提出了多种理论,比如EMT理论、干性理论、癌症代谢理论和Notch-Delta理论。在之前的研究中,他们已发现激活 这种信号通路的配体是如何发生差错从而让迁移性的癌细胞保持在一起并帮助它们附着到身体新部位的结缔组织上。
Sci Rep:华人学者发现抗癌新靶标,死死控制脑胶质瘤命门!doi:10.1038/s41598-018-31864-x
来自弗吉尼亚理工-加利永研究所(Virginia Tech Carilion Research Institute,VTCRI)的研究人员表示一个涉及人体生物节律的基因也许是致命的脑胶质瘤的一个潜在治疗靶标。这项新发现于近日发表在《Scientific Reports》上,题为“Casein Kinase 1 Epsilon Regulates Glioblastoma Cell Survival”,该研究指出一个特殊基因可以很明显地维持肿瘤细胞生存,尽管这个基因通常与生物节律有关。“我们已经发现抑制这个基因也许可以抑制肿瘤干细胞自我更新并分化成为胶质瘤细胞的能力,而肿瘤干细胞被认为是这类难治疗的癌症的特点之一。”该研究作者、VTCRI副教授Zhi Sheng说道。“尽管在设计一种新疗法之前还需要更多的研究,但是我们这项早期基础研究很有希望。”Sheng表示在手术、放疗和化疗后就算只有几百个胶质瘤干细胞还存活,这种癌症就会再复发。但是在他们关于癌细胞和小鼠模型的实验中,研究人员发现酪蛋白激酶1家族中的一个成员产生的酶被抑制后,胶质瘤干细胞的增殖就会停止,小鼠身上的肿瘤生长也会受到抑制。研究人员还发现了证据表明这个酶负责调节胶质瘤干细胞自我更新的速度,而不是控制分化。“抑制这个基因可以有效杀死胶质瘤干细胞。”Sheng说道。Sheng和他的同事还评估了两种商用的抑制酪蛋白激酶1的药物,发现其中之一就有进一步研究成为脑胶质瘤干细胞抑制剂的潜力。
Front Cell Neurosci:一种新技术有望通过激活癌细胞来治疗癌症doi:10.3389/fncel.2018.00388近日,一项刊登在国际杂志Frontiers in Cellular Neuroscience上的研究报告中,来自俄罗斯远东联邦大学的科学家们通过研究提出了一种新型的抗癌疗法,即通过激活癌细胞来破坏它们。 文章中,研究人员对神经胶质瘤干细胞的分子激活机制进行了研究,研究者们重点关注了癌症干细胞从睡眠模式向觉醒模式的转变,以及如何进一步激活其发生分裂;癌症干细胞是一类非常罕见的干细胞,其不仅能够负责肿瘤的生长和扩散,还能引发癌症复发给患者治疗带来极大困难,肿瘤经常会在患者接受化疗或外科手术后发生复发,有时候也需要很长时间才能诱发癌症复发的过程。目前临床上癌症患者治疗的困难在于癌症干细胞仅会在其处于活性阶段受到影响,而这是很难被检测到的;研究者Alexander Kagansky教授说道,干细胞激活的方法风险很大,然而在其处于被动状态下,这些细胞几乎会对化疗产生免疫,在晚期肿瘤这种情况下,患者必须在某种特定治疗方法的潜在风险和益处之间进行权衡选择,文章中,研究人员所开发的新方法就能够重新激活癌症干细胞,而这或许也有望帮助开发治疗癌症的新型疗法。据研究者介绍,胶质瘤干细胞(glioma stem cells, GSCs)拥有多种保护性的机制,其会使得靶向性疗法无法有效发挥疗效,在治疗过程中,特定类型的细胞通道常常会被阻断,而这一阻断通常会由在不同水平下发挥作用的多种分子链接来补偿。研究者的想法就是让胶质瘤干细胞重新开启细胞周期循环,从而让其处于激活状态,这样在这些肿瘤细胞还未进入休眠状态被保护的情况下,研究者就能利用化疗手段对其发起突然攻击。
Oncogene:利用一种新型药物运输系统来运输抗癌药物有望降低肿瘤尺寸doi:10.1038/s41388-018-0406-x近日,一项刊登在国际杂志Oncogene上的研究报告中,来自大阪大学和东京工业大学的科学家们通过研究在肝细胞癌(HCC)干细胞中发现了一种名为CD13的表面分子,当CD13抑制剂乌苯美司(Ubenimex)加入到癌症干细胞中时,肝细胞癌干细胞就会诱发程序性细胞死亡程序进而被消除;然而由于癌症干细胞仅存在于部分肿瘤组织中,因此研究人员就需要开发出一种新方法,将高浓度的药物运输至作用靶点。研究人员开发的这种药物运输系统能利用乙二醇—赖氨酸嵌段共聚物—乌苯美司共轭物(PEG-b-PLys(Ube))来发挥作用,该系统能增加药物乌苯美司靶向作用癌症干细胞的浓度,此外,结合使用标准的抗癌药物还能明显降低癌症干细胞的水平。研究者Masamitsu Konno说道,这项研究中我们首次开发出了一种运输高浓度乌苯美司的药物运输系统,利用这种方法,研究人员就能对小鼠进行药物乌苯美司的腹腔注射和静脉注射,结果表明,小鼠机体的肿瘤尺寸明显减小了,因此研究人员就有望将高浓度的乌苯美司运输至癌症干细胞靶点。下一步,研究人员将乌苯美司与当前的抗癌药物结合使用,来加速小鼠机体中癌症干细胞的细胞凋亡,这些抗癌药物包括氟尿嘧啶、顺铂和多柔比星。最后研究者Hideshi Ishii说道,如今这些药物对癌症干细胞的作用已经被证实,本文研究结果或将促进这些药物用来治疗多种类型的癌症;同时这种新型运输系统中的嵌段共聚物模块也能被轻松制造并表现出更强的效应,这或许有望应用于其它药物中。
ACS Cent Sci:一种新型分子探针让癌症干细胞无处可逃doi:10.1021/acscentsci.8b00313在治疗原发性肿瘤后,癌症干细胞仍然可能潜伏在体内,作好转移到身体其他部位的准备并以更具侵袭性和抵抗治疗的形式导致癌症复发。在一项新的研究中,来自美国伊利诺伊大学香槟分校的研究人员开发出一种分子探针来找出这些难以捉摸的癌症干细胞并照亮它们,这样不仅能够在体外的细胞培养物中而且也能够在天然环境---身体---中鉴定、追踪和研究它们。他们描述了利用这种分子探针在多种人癌细胞系的体外培养物中和活小鼠体内鉴定出癌症干细胞的有效性。相关研究结果于2018年7月25日在线发表在ACS Central Science期刊上,论文标题为“Surveillance of Cancer Stem Cell Plasticity Using an Isoform-Selective Fluorescent Probe for Aldehyde Dehydrogenase 1A1”。
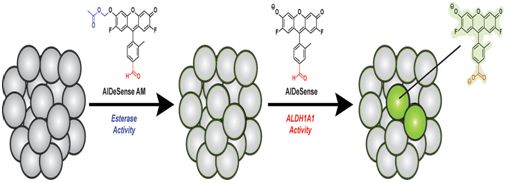 图片来自ACS Central Science, doi:10.1021/acscentsci.8b00313。
图片来自ACS Central Science, doi:10.1021/acscentsci.8b00313。
论文通信作者、伊利诺伊大学香槟分校化学教授Jefferson Chan说,“这真地是首次能够在癌症干细胞存在的复杂环境中观察到它们---不仅仅是在体外的细胞培养物或者人工肿瘤微环境中。观察到它们是理解它们的第一步。如今,我们能够观察到它们潜藏在何处,随着疾病的进展,它们如何发生变化,或者当进行治疗时,它们如何作出反应。”这种被称作AlDeSense的新型分子探针是一种小分子,可与癌细胞中的一种与干性(stemness)性质相关的酶---乙醛脱氢酶1A1(ALDH1A1)---相结合。仅当这种分子探针与ALDH1A1发生反应时,它会被激活,从而释放出荧光信号。癌症干细胞会产生高浓度的ALDH1A1。在一系列实验中,Chan团队发现这种酶似乎是许多癌症类型中的一种干性标志物,这就表明AlDeSense可能广泛地应用于临床成像。当然,随着癌症干细胞的分化,这种标志物会消失掉。 这些研究人员证实AlDeSense可与两种主要的细胞技术---流式细胞术和共聚焦成像---相兼容。Chan团队随后与伊利诺伊大学香槟分校兽医临床医学教授Timothy Fan合作,在从接受活组织检查的小鼠体内切除的组织中和活的患有转移性肿瘤的小鼠体内寻找和追踪癌症干细胞。
来源:IMICAMS 中国医学科学院医学信息研究所
原文链接:http://mp.weixin.qq.com/s?__biz=MzUxNzc5MzUwNw==&mid=2247484529&idx=1&sn=dc49911b4445812bbe4d6692f37d438e&chksm=f993f7fdcee47eeb38878c4bac428cd6ffe59db2818da0f8680bf84081d102fdd28fb37b7a4e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn




