来源:BioArt
乳腺癌是临床上比较常见的恶性肿瘤,其可分为四大亚型,包括腔面A(luminal A),腔面B,HER-2阳性和三阴性乳腺癌(Triple-negative breast cancer,TNBC)。三阴性乳腺癌是最难治愈的一种,其主要分型特点为雌激素受体(ER,estrogen receptor)、孕激素受体(PR,progesterone receptor)和原癌基因HER-2均为阴性。相比其他亚型,TNBC发展迅速,容易转移和复发,恶性程度较高。针对TNBC的治疗,一方面由于其激素受体和HER-2都是阴性,针对这两部分的靶向治疗收效甚微。其次,化疗产生的肿瘤耐药性,使得患者中位生存期大概为8-13个月【1】。
研究表明,针对PD-1/PD-L1的检查点阻断疗法对黑色素瘤、食管癌等癌症治疗效果显著。然而,PD-1/PD-L1免疫检查点阻断疗法在TNBC的治疗中却存在应答率较低(5%)的问题,选择肿瘤微环境(tumor microenvironment, TMEs)中PD-L1阳性的病人对其进行免疫治疗则可以将应答率提升至19-23%【2】,尽管如此,大多数的TNBC患者并不能从PD-1/PD-L1免疫检查点阻断疗法中获益,这也强调了,我们需要找到方法以增强肿瘤微环境对PD-1阻断的敏感性以实现更为有效的治疗效果。
临床前和临床研究表明,低剂量化疗或放疗可以用来刺激抗肿瘤免疫反应。已有研究表明辐照可以通过cGAS-STING信号通路诱导I型干扰素产生,从而增强T细胞启动。环磷酰胺(Cyclophosphamide,CTX)可造成调节性T细胞衰竭并且可以恢复T细胞和自然杀伤细胞的效应功能【3】。此外,顺铂(Cisplatin)可以上调MHC1表达,直接对T细胞功能起促进作用【4】。阿霉素(doxorubicin)与髓系来源的抑制性细胞MDSC(myeloid-derived suppressor cell)衰竭,I型干扰素水平的增加以及诱导免疫原性细胞死亡密切相关【5】。
鉴于TNBC免疫阻断治疗中存在的免疫应答效果差这一难题,寻找针对TNBC的有效治疗方法至关重要。
2019年5月14日,Nature Medicine杂志上发表了一项由来自荷兰癌症研究所(The Netherlands Cancer Institute)的Marleen Kok团队领衔完成的工作Immune induction strategies in metastatic triple-negative breast cancer to enhance the sensitivity to PD-1 blockade: the TONIC trial,即针对TNBC患者存在的对PD-1/PD-L1免疫阻断应答低应答率的临床问题,实施TONIC计划,通过临床试验发现短期doxorubicin和cisplatin化疗后,可诱导产生更有利于治疗的肿瘤微环境,增加TNBC对PD-1阻断的应答,同时结合Nivolumab(抗PD-1靶向药)进行的序贯治疗可提高PD-1/PD-L1免疫检验点阻断疗法对TNBC的疗效。

TONIC计划中,70名患者被随机分配到4种不同的治疗方案(单一病灶放疗,低剂量环磷酸胺,顺铂或阿霉素)其中一组治疗组以及对照无治疗组(图1)。研究人员在治疗开始前基线期,诱导治疗2周后以及nivolumab三次循环治疗后均对病人进行活检。最后,有68位病人接受了至少1轮的nivolumab治疗,67位病人的数据可以用作生存期分析,66位病人的数据可以用作疗效分析。
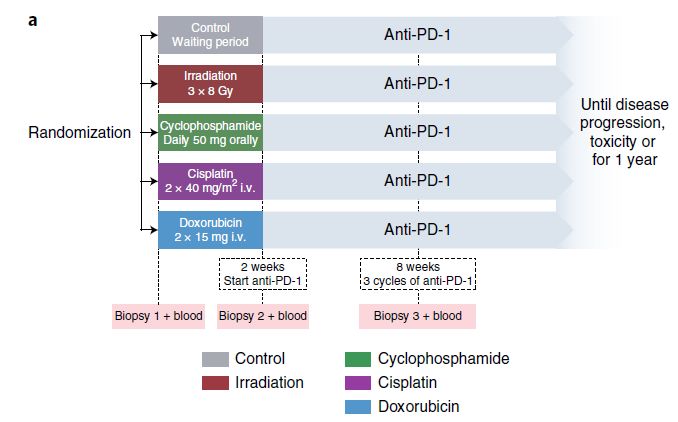
图1 TONIC计划治疗方案
研究人员观察到病人总体治疗的客观反应率(objective response rate,ORR;iRECIST)为20%,而短期阿霉素治疗组ORR为35%,其次为短期顺铂治疗组ORR为23%。
同时,研究人员探讨了病人肿瘤微环境和外周血的临床特征和基线资料潜在的预测价值。研究人员发现在对nivolumab产生应答的病人样本中免疫细胞间质肿瘤浸润淋巴细胞(sTILs)和CD8以及PD-L1的水平明显高于未产生应答的组别。此外,应答者体内的癌抗原15-3(CA15-3)和癌胚抗原(CEA)显著降低。同时伴随着辅助性T细胞1(Th1),B细胞还有中性粒细胞相关基因表达升高。试验中,有2位肿瘤突变负荷高的病人发生了体细胞突变(POLE)。其中一例突变经确定是由微卫星不稳定造成的,并且产生了持久的应答。在基线期并未在病人中发现B2M基因的突变。除此之外,研究人员发现应答反应和病人BRCA1/2突变之间并没有联系,但是BRCA1样基因组拷贝数与应答反应呈现负相关关系。
接下来,研究人员探讨了诱导治疗是否能诱发有利的炎症性肿瘤微环境。研究人员首先对不同治疗组正在进行抗肿瘤免疫反应产生应答的应答者和未应答者进行活检(biopsy 3)。在对无短期处理nivolumab治疗期组的活检中,研究人员观察到了应答者的TCR克隆性扩增,T细胞浸润增加。虽然与无短期处理对照组相比,短期顺铂和阿霉素治疗组在nivolumab治疗后(biopsy 3 vs biopsy 1)T细胞克隆总数显著增加,但是这种组间差异并未在短期诱导后观察到(biopsy 2 vs biopsy 1)。此外,研究人员观察到,顺铂和阿霉素诱导后T细胞浸润程度有增加的趋势(biopsy 2 vs biopsy 1),这种情况在nivolumab治疗后更为明显(biopsy 3 vs biopsy 1)。
接着,研究人员评估了诱导治疗引起的免疫相关的基因表达变化,在nivolumab(biopsy 3)治疗后,应答者活检结果表明炎症相关的信号通路上调。在顺铂和阿霉素诱导治疗后,大多数验证相关因子的信号表现出持续上升的趋势,在进行nivolumab治疗后,信号上调更为明显。特别的,阿霉素诱导后炎症相关基因,JAK-STAT,TNF-α信号通路显著上调。而在辐照或是2周等待期处理组的结果表明,这些信号表现出下降的趋势(biopsy 2 vs biopsy 1)。
本研究表明短期化疗诱导后应用nivolumab治疗是可行的,并可以使相当一部分患者受益。尽管如此,TONIC计划仍存在着一些局限性,首先试验对象只有TNBC患者,就以往的治疗和肿瘤转移模式而言,这一群体对象选择是比较单一的。其次,试验的第一阶段也未进行分层研究,可能造成数据分析失衡。接着,因为试验要求短时间内优先招募阿霉素试验组对象,以获得至少10个高质量的配对活检对象,故而不能排除低剂量阿霉素也可能具有直接的抗肿瘤作用。研究人员对针对PD-1/PD-L1和阿霉素的ORR标准选择不同也会影响最后的结果。
总的来说,在本研究中,治疗前期采用阿霉素或顺铂似乎能诱导产生更有利治疗的肿瘤微环境,并且能对nivolumab治疗产生更好的免疫应答效果。本研究的试验设计也为乳腺癌以及其他肿瘤疾病的信号诱导联合免疫治疗研究提供了新的思路。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652469883&idx=2&sn=49ca1e068f3e7cb709591cd481b8d96a&chksm=84e2e9cfb39560d91dd46fa23d64e7d3f109e91645e0a289500bccf9fdbb5952124aad024afe&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


