来源:中国医学科学院医学信息研究所
肠道是人体最大的消化和排毒器官,其回旋盘转的结构被形象地称为人体第二大脑。肠道中寄生着数以计亿的细菌,它们是人体内最重要的一种外环境,各种微生物按一定比例组合,相互制约,相互依存,在质和量上形成一种生态平衡。
然而,肠道菌群并不都是人类的朋友,按特性来讲,它们可分为3大类,即好菌、坏菌和中性菌。当人体肠道中好菌比例下降而坏菌数量上升时,人体免疫力下降,极易导致多种疾病的发生。研究表明,肠道菌群紊乱与多种疾病的发生密切相关,如消化系统疾病、内分泌系统疾病、精神系统疾病、自身免疫性疾病以及一些感染性疾病。基于此,本文针对肠道微生物组最新研究进展,进行一番梳理,以飨读者。
Science子刊:抗生素复方新诺明可减少HIV感染者的不良健康事件doi:10.1126/scitranslmed.aav0537在一项新的研究中,来自英国、加拿大、乌干达和津巴布韦的研究人员发现一种称为复方磺胺甲恶唑(cotrimoxazole,也称为复方新诺明)的常用抗生素可降低儿童HIV病毒感染者的不良健康事件。相关研究结果发表在2019年4月3日的Science Translational Medicine期刊上,论文标题为“Cotrimoxazole reduces systemic inflammation in HIV infection by altering the gut microbiome and immune activation”。在这篇论文中,他们描述了在年轻的HIV患者中测试这种抗生素的有效性以及他们获得的发现。
图片来自NIAID。
这些研究人员给生活在乌干达和津巴布韦的293名儿童HIV感染者提供了复方磺胺甲恶唑,为时96周。他们随后收集了所有儿童HIV感染者的血浆样本,随后停止对其中的一半儿童给送这种抗生素。他们在48周后再次收集了所有儿童的血浆样本,并对他们发现的结果进行了比较。这些研究人员报道相比于停止服用复方磺胺甲恶唑的儿童,继续接受这种药物治疗的儿童具有更低的全身性炎症。他们还发现肠道中的链球菌活性水平下降了。更具体地说,他们发现停止服用这种抗生素的儿童出现不良健康事件的可能性比继续使用该药的儿童高出18%。在进一步研究这种抗生素对身体的影响时,这些研究人员发现在16名成年HIV感染者中,它对免疫细胞有直接影响,能够抑制炎症分子产生。他们得出的结论是,尽管对这种抗生素产生广泛的抗药性,但是给HIV毒感染者提供这种药物能够在一定程度上缓解这些感染者身上出现的健康不良事件。
Cell:肠道细菌研究的下一个前沿领域:挖掘肠道细菌产生的分子doi:10.1016/j.cell.2019.03.036人类的肠道拥有数万亿个看不见的微生物,它们被称为肠道菌群,共同产生数以千计的独特小分子。绝大多数这些分子的来源和生物学功能都是未知的。在一项新的研究中,来自美国耶鲁大学的研究人员利用一种新技术发现了源自肠道菌群的影响人体生理学特征的化学物,从而揭示出一种可能对人体健康产生广泛影响的复杂相互作用网络。相关研究结果于2019年4月18日在线发表在Cell期刊上,论文标题为“A Forward Chemical Genetic Screen Reveals Gut Microbiota Metabolites That Modulate Host Physiology”。论文通讯作者为耶鲁大学医学院的Noah Palm。Palm及其团队使用了一种称为PRESTO-Tango的化学筛选技术,它可一次同时测试数千种人类受体。通过这种方法,他们鉴定出释放激活一组特定受体的小分子的人体肠道细菌。鉴于这些受体调节一系列生理功能,他们推断这些产生小分子的肠道细菌也会影响人类生物学的各个方面。Palm团队培养并筛选了100多种不同的肠道细菌,用于产生激活宿主受体的分子,并揭示了肠道细菌与它们的人类宿主之间的多种化学相互作用。
Science:新研究发现太空飞行影响人体肠道细菌doi:10.1126/science.aau8650; doi:10.1126/science.aaw7086在美国航天局(NASA)标志性的双胞胎研究(Twins Study)中,美国研究人员发现长时间的太空飞行会影响人体肠道微生物组(gut microbiome)。相关研究结果发表在2019年4月12日的Science期刊上,论文标题为“The NASA Twins Study: A multidimensional analysis of a year-long human spaceflight”。在国际空间站(ISS)长达一年的时间里,宇航员Scott Kelly在他的肠道微生物组中经历了两种主要细菌类型的比例变化。然而,他的肠道微生物组中的细菌多样性在太空飞行期间没有改变,这一发现令这些研究人员倍感鼓舞。

在西北大学开展的这项肠道微生物组研究是发表在2019年4月12日的Science期刊上的一篇综合性论文中的十项研究之一。在这10项研究中,每项研究都探讨了太空飞行如何影响人体的一个方面,包括基因表达、骨密度、免疫系统反应和端粒动力学的变化。从2015年到2016年,Scott Kelly成为第一位在太空中度过近一整年的美国宇航员。Scott Kelly和他的同卵双胞胎兄弟---一名退役的宇航员--- Mark Kelly参加了由美国宇航局人类研究计划开展的一项前所未有的长达一年的研究。Mark Kelly为地球上的观察结果提供了基线,Scott Kelly在太空中提供了一个类似的测试案例。这些研究人员研究了Scott Kelly肠道中的细菌组成随着时间和空间的变化而发生的变化。这对双胞胎在Scott Kelly前往太空前、在太空的一年期间和在返回地球后分别收集了后者的两份、四份和三分粪便样本。90%以上的肠道细菌属于两大类:厚壁菌(Firmicutes)和拟杆菌(Bacteroidetes)。这两种细菌类型都含有有益菌和有害菌。Scott Kelly的肠道微生物组中的厚壁菌和拟杆菌之间的比例在太空飞行期间经历了明显的变化---厚壁菌的数量增加了,而拟杆菌的数量减少了。这种变化是这些研究人员在Scott Kelly的肠道微生物组中观察到的更大的组成变化之一,他的肠道微生物组在返回到地球后恢复正常。
Sci Transl Med:一种良性的肠道细菌或会不断进化引发致死性的血液感染doi:10.1126/scitranslmed.aat8418近日,一篇发表在国际杂志Science Translational Medicine上的研究报告中,来自美国多家研究机构的科学家们通过研究阐明了一种常见的人类肠道细菌如何通过进化的方式转变成为致死性的病原体,文章中,研究者描述了粪肠球菌(enterococcus faecalis)的进化历史特性。粪肠球菌不仅能很好地抵御机体免疫系统,还具有一定的耐药性,甚至并不会受到医院所使用的清洁剂的影响,医院的研究人员并没有深入研究这种细菌的进化机制和原因,研究人员想通过更换清洁剂来将这种细菌消灭,幸运的是,他们还冻存了细菌的样本供以后进行研究,这项研究中,研究人员就对保存的样本进行了深入分析并阐明了这些细菌是如何发生改变的。研究人员对多个样本中细菌的行为和基因组进行了研究,他们发现这些细菌与肠道中其它的细菌并不相同;除了会产生抗生素耐药性外,粪肠球菌还会产生毒素并对酸性pH环境耐受,这些细菌会通过基因突变的方式来获得上述能力,其中一种改变就是抵御宿主机体免疫系统的攻击,同时还会产生抗生素耐药性;此外研究者还发现,在所检测的样本中细菌发生的突变并不一致,即粪肠球菌一直在不断进化,自20世纪80年代以来粪肠球菌引发的血液感染在很多地方都出现过,但幸运的是如今研究人员知道如何采取措施来消灭它。
Nat Commun:肠道微生物组或能指挥机体免疫系统抵御癌症doi:10.1038/s41467-019-09525-y近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自Sanford Burnham Prebys医学发现研究所的科学家们通过研究阐明了肠道微生物组和机体免疫系统抵御癌症能力之间的因果关联,文章中,研究者鉴别出了11种细菌,其能激活小鼠的机体免疫系统并减缓黑色素瘤的进展,此外研究者还阐明了一种未折叠蛋白反应(UPR,unfolded protein response)的关键作用,UPR是一种能维持蛋白质稳态的细胞信号通路,研究人员在对免疫检查点疗法产生反应的黑色素瘤患者机体中常常能观察到UPR水平的下降,这或许就能揭示对病人分层的潜在标志物。研究者Thomas Gajewski说道,免疫疗法能够延长很多癌症患者的寿命,通过研究患者对疗法产生反应和耐受的分子机制,我们就能够扩大因化疗而受益患者的数量。这项研究中我们建立了微生物组和抗肿瘤免疫力之间的关联,同时揭示了UPR在这一过程中扮演的关键角色,相关研究结果或能帮助研究人员对接受选择性检查点抑制剂疗法的黑色素瘤患者进行分类。此外,研究者还对缺少RING指蛋白5(RNF5)基因的小鼠模型进行了研究,RNF5是一种特殊的泛素连接酶,其能帮助移除错误折叠或损伤的蛋白质,由于这些分子特征对于当前研究都非常重要,但小鼠似乎并未表现出任何疾病的外部迹象。然而缺少RNF5的小鼠能够抑制机体中黑色素瘤的生长,这就表明其机体拥有完整的免疫系统和肠道微生物组,研究者发现,UPR信号水平的下降往往与小鼠机体中肠道微生物改变有关。当他们对来自黑色素瘤患者的组织样本进行分析后发现,UPR组分(sXBP1, ATF4和BiP)表达水平的降低与患者对疗法产生反应直接相关,这就表明,或许存在潜在的预测性生物标志物能够帮助筛选接受免疫检查点疗法的黑色素瘤患者。
Science:揭秘真菌病原体进化成为机体肠道共生体的分子机制doi:10.1126/science.aat0537近日,一项刊登在国际杂志Science上的研究报告中,来自新加坡A*STAR研究所的科学家们通过将致病性酵母转化成为一种免疫共生体,揭开了机体肠道进化和通用性疫苗背后的奥秘。当试图增加酵母对非原生宿主的致病性时,研究者意外地将真菌转化成了共生的肠道菌群,其能支持宿主的生存而不是对抗宿主。

图片来源:CC0 Public Domain
研究者Norman Pavelka表示,我的第一假设或许完全错了,我们希望能够利用对人类致病性的白色念珠菌进行研究,并将其重复暴露于新的宿主(小鼠),这样就能够选择并接种最好的宿主并使得小鼠机体中的病原体不断进化。这一过程被称为“连续传代”,其类似于经典的减毒活疫苗,比如脊髓灰质炎和天花疫苗的生产过程,通过迫使病原体反复适应新的物种,其就会对人类失去毒力。让研究人员惊讶的是,传代后的白色念珠菌会失去对新宿主的致病性,研究者意识到他们使用小鼠的肠道作为选择性的环境而并非血流,这或许是“罪魁祸首”。胃肠道是机体微生物和平共处的环境,而选择性压力则是完全不同的,包括小鼠在内的许多动物都会摄入对方的粪便,这就提供了病原体传播的媒介,而微生物会在宿主的胃肠道中进化,并不会导致宿主死亡,而且还会传播到新的宿主机体中。研究者还发现,白色念珠菌的互惠突变还会受到其它肠道菌群的影响,这就提示,白色念珠菌需要在一个有竞争力的环境中维持其毒力特性,这或许也能够解释为何白色念珠菌与其天然宿主(人类)并不存在共生关系,因为其会被宿主机体中的其它微生物所击败。定植或接种白色念珠菌的小鼠往往也会在其它致命性注射中存活,这包括不仅仅是野生型、有毒力的白色念珠菌,而且还包括其它不想管的致病性真菌和细菌。
Nature:相同的微生物为何在不同的个体中会产生不同的效应?doi:10.1038/s41586-019-1065-y机体的肠道微生物组与多种疾病的发生直接相关,包括肥胖、心脏病、糖尿病、甚至神经性障碍和癌症等疾病;近些年来,科学家们一直在对组成微生物组的多种细菌进行分类,来确定哪一种菌群可能与特定的疾病发生有关;近日,一项刊登在国际杂志Nature上的研究报告中,来自魏茨曼科学研究学院等机构的科学家们就通过研究回答了这样一个问题,即如果相同的微生物在不同个体机体中表现不同会引发什么问题?研究人员开发了一种新型算法,其能够系统性地鉴别出人类肠道微生物组中的结构变异,研究者首先对来自900名以色列受试对象机体的微生物组进行分析,成功识别出了7000多个变异,随后他们通过联合研究在一大群荷兰受试者机体中寻找这些突变,研究者在以色列受试者机体中识别出的大部分结构变异在荷兰受试者机体中也存在(尽管不同群体之间的遗传特性和生活方式存在一定差异)。随后研究者询问这些受试者所鉴别出的结构变异是否与其健康或疾病状况相关,受试者出现了100多个与疾病风险相关的变异,其中许多关联性在荷兰受试者中也出现了。研究者对编码突变的基因进行分析后发现,该基因能帮助细菌将特定糖类转化成为丁酸盐,丁酸盐具有抗炎性效应,而且对机体代谢有着积极影响,这或许就能够帮助解释拥有携带突变和未携带突变细菌的个体之间体重的差异。研究者所开发的方法能够帮助阐明微生物组、健康和疾病之间的关联,同时也能帮助科学家们鉴别出其关联性背后的机制。
Nature:重磅!科学家揭开人类机体无法培养的肠道菌群的奥秘!doi:10.1038/s41586-019-1058-x近日,一项刊登在国际杂志Nature上的研究报告中,来自劳伦斯伯克利国家实验室等机构的科学家们通过对3810个公开的人类肠道宏基因组进行计算重建,展示了大约6.1万个微生物基因组,这些宏基因组是微生物组样本中存在的所有遗传物质的集合,宏基因组组装的基因组(MAGs)包括2508种此前未知的物种,从而使得已知的人类肠道细菌种类达到了4558种,并使得已经测序的肠道菌群的系统发育多样性增加了50%。通过将无法培养的菌群的重建基因组与能进行培养菌群的基因组进行比较,研究者发现,无法培养的细菌菌群的基因组平均小20%,并且其缺少多种脂肪酸、氨基酸和维生素的生物合成途径,无法培养的肠道菌群中所缺失的常见基因或许对细菌的生长至关重要,当然了这或许也是此前研究中并未关注的方面。在名为IGGsearch的新型工具的帮助下,研究者将10种不同疾病患者机体的微生物组与健康个体进行对比后发现,大约40%的微生物疾病与此前认为并没有基因组的物种或许有关;比如研究者发现的其中一种新的物种—Negativicutes菌群,其在强直性脊柱炎的患者机体中明显缺失,绘制出强直性脊柱炎患者机体中该菌群基因组的变化图谱对于深入阐明疾病发生至关重要,此外,研究者还利用IGGsearch微生物组特性构建出了用于疾病研究的预测性模型,结果发现,与当前工具相比,这种新型工具的预测准确性会明显提高。后期研究者希望能够继续深入研究揭开人类肠道中更多无法进行培养的微生物菌群,并利用人类肠道微生物组作为模型来阐明多种计算工具的有效性。
Cell Rep:中国科学家新发现!肠道菌群或能帮助人类抵御寒冷!doi:10.1016/j.celrep.2019.02.015肠道微生物组对人类和动物机体健康有着多样的影响,近日,一项刊登在国际杂志Cell Reports上的研究报告中,来自中国科学院遗传与发育生物学研究所的科学家们通过研究揭示了肠道菌群在机体温度调节(thermoregulation)中扮演的关键角色,温度调节时动物对寒冷环境做出的反应。

图片来源:QI Lei。
目前研究人员已经证明,在寒冷暴露中,动物能够通过激活棕色脂肪组织(BAT)来产生热量,同时通过促进白色脂肪组织“褐变”的方式来维持体温;为了能够分析肠道菌群在激活BAT过程中发挥的功能,研究人员利用不同的抗生素清除掉了动物机体中的肠道菌群,随后他们发现,缺少肠道菌群的动物会出现机体温度调节功能的损伤。此外研究者还在无菌小鼠体内证实了上述结果,尤其是研究者发现,移除肠道菌群能够抑制BAT中解偶联蛋白1(UCP1)表达的增加,同时还会降低白色脂肪组织褐变的水平;引发这种效应的原因或许是机体完整微生物组的缺失,以至于动物无法消化足够的食物来满足寒冷状态下能量需求的上升,而且这对BAT的影响也是一种继发效应。然而研究者发现,通过给动物灌喂细菌代谢产物—丁酸盐(butyrate)就会增加治疗小鼠体内的生热能力,从而就会逆转肠道菌群缺失所产生的影响;研究结果表明,肠道菌群在刺激动物机体寒冷诱导的产热过程中扮演着关键的信号角色;本文研究结果扩展了研究人员对肠道微生物组影响机体生理和健康领域的认知,当前研究在小鼠机体中进行,研究人员呼吁进行人类试验时需要谨慎,因为这可能对人类健康会产生一些影响。
Nat Immunol:发现免疫系统维持健康的肠道微生物的关键机制doi:10.1038/s41590-019-0316-2来自德国的研究人员已经发现了一种控制对抗肠道微生物免疫反应的关键机制,这项跨国研究的结果将帮助开发出治疗慢性炎症性肠道疾病的新方法,相关研究成果于近日发表在《Nature Immunology》上。免疫系统会保护小肠防止其中的病原性细菌的传播,同时免疫系统还允许益生菌的生长繁殖。反过来,肠道微生物的组成对免疫反应的质量有影响。一个由德国基尔大学(CAU)Alexander Scheffold博士领导的研究团队揭示了维持肠道微生物和免疫反应之间的平衡的关键机制。研究人员研究了小鼠免疫-微生物相互作用的分子调控元件,研究人员聚焦于一种叫做调节性T细胞的免疫细胞,这些免疫细胞可以防止小肠中有害甚至是有益的微生物被免疫系统攻击。“我们发现一个叫做c-Maf的分子对于肠道中特异性的调节性T细胞的发育和功能至关重要。”Scheffold解释道。C-Maf可以防止免疫系统攻击肠道微生物。“如果没有这个分子,肠道免疫系统就会过度反应,肠道微生物的组成会发生巨大的变化。”该研究第一作者Christian Neumann博士说道。这种组成的改变相当稳定:当研究人员将改变的微生物移植到携带完整c-Maf调节的T细胞的小鼠体内后,它们还是会使小肠免疫系统过度反应。
Cell:肠道细菌与哺乳动物宿主之间存在一种通用的沟通策略---一氧化氮doi:10.1016/j.cell.2019.01.037肠道中的细菌不仅帮助哺乳动物宿主消化胃部中的食物,还能够告诉它们的宿主基因该做什么。如今,在一项新的研究中,来自美国凯斯西储大学医学院、克利夫兰医学中心和哈佛医学院的研究人员描述了一种“物种间沟通(interspecies communication)”方法:细菌分泌一种称为一氧化氮的特定分子,从而允许它们与宿主DNA进行沟通并控制宿主DNA,这提示着这两者之间的交谈可能广泛地影响人类健康。相关研究结果发表在2019年2月21日的Cell期刊上,论文标题为“Regulation of MicroRNA Machinery and Development by Interspecies S-Nitrosylation”。
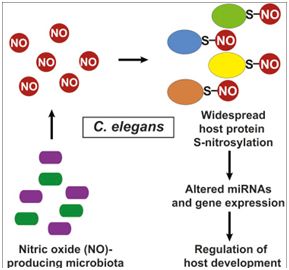
图片来自Cell, 2019, doi:10.1016/j.cell.2019.01.037。
这些研究人员追踪了秀丽隐杆线虫(一种常见的哺乳动物实验室模型)体内的肠道细菌分泌的一氧化氮。肠道细菌分泌的一氧化氮结合到成千上万的宿主蛋白上,从而完全改变了线虫调节它的自身基因表达的能力。这项研究首次发现肠道细菌能够利用在包括人类在内的哺乳动物中普遍存在的一氧化氮网络。一氧化氮以一种严格受到调控的方式--一种称为S-亚硝基化(S-nitrosylation)的过程---结合到人体蛋白上。这个过程受到破坏广泛地与阿尔茨海默病、帕金森病、哮喘、糖尿病、心脏病和癌症等疾病有关。这些研究结果表明一氧化氮是肠道细菌与哺乳动物宿主进行沟通的一种通用机制。之前破解与肠道细菌之间的通信路径的研究主要集中在细菌分泌的罕见分子上。论文通讯作者、凯斯西储大学医学院转化分子医学研究所主任和克利夫兰医学中心哈灵顿发现研究所主席Jonathan Stamler博士说,这些新发现类似于揭示不同物种之间的一种共同的化学语言。他说,“肠道中存在极大的复杂性,许多科学家们正在寻找细菌产生的另一种可能影响人类健康的不寻常物质。”鉴于肠道中一般存在着数万亿个细菌,Stamler决定寻找所有细菌物种都可能使用的共同语言。“肠道细菌群体的巨大规模及其与宿主之间的关系预示着存在我们人类能够别出的通用沟通方式。”
来源:IMICAMS 中国医学科学院医学信息研究所
原文链接:http://mp.weixin.qq.com/s?__biz=MzUxNzc5MzUwNw==&mid=2247484498&idx=1&sn=9f3fdb9270b8270db254d895d07507e3&chksm=f993f7decee47ec8dd0dcc5d2822166209c78dab45329a1c7b8afdd39aac0353a3798973583f&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



