来源:BioArt
人类遗传学旨在理解遗传变异如何影响复杂性状和疾病。近年来,全基因组关联研究(Genome-wide association studies,GWAS)已鉴定出数千种与复杂表型相关的遗传变异。2017年发表在Cell杂志上的一篇文章对此提出一种创新的理解—“全方位基因模型(Omnigenic model)”【1】,即几乎所有基因都可以影响性状和疾病发生,在任何细胞中都可能存在50~100个核心基因(core genes)与指定性状直接相关,同时存在另外1万个周边基因(peripheral genes)与该性状间接相关。然而,该模型对各种复杂性状和疾病的适用程度仍存在争议。
造血被认为是这类研究的范例。血细胞生成(红细胞、白细胞和血小板)是高度受控、分级及内在的过程,其与组织氧输送、炎症反应、,动脉粥样硬化和血栓形成的关系密不可分。因此,影响人群内血细胞特性差异的因素同样可能在同类人群的慢性疾病发病机理和健康差异中发挥重要作用。
值得注意的是,血液学特征的分布和遗传性血液病的患病率因种族而异。由于血细胞在病原体的侵袭,防御和炎症反应中的关键作用,加之人口迁移史和局部进化选择压力,与血液学相关的遗传基因座更倾向在血统人群中分型。例如,与欧洲血统个体相比,非洲血统个体中贫血和微细胞增多症的患病率更高,部分原因是在非洲,地中海,亚洲人群中更常见珠蛋白基因突变(例如镰状红细胞,α/β地中海贫血)【2】。迄今为止,尽管在理解与血细胞生成相关的遗传基因座方面已有部分进展,但对于完成绘制覆盖不同种族人群的遗传变异谱仍任重而道远。
2020年9月3日,Cell 杂志接连发表两篇文章,利用GWAS对人类血液学特征及相关疾病进行不同形式的分析。
其中一篇为来自英国桑格研究院的Nicole Soranzo课题组与来自美国哈佛医学院的Vijay G. Sankaran课题组合作发表的题为“The Polygenic and Monogenic Basis of Blood Traits and Diseases”的文章,通过对英国生物库中血细胞特征的分析阐明了造血表型的完整遗传结构,验证并支持复杂性状的“全方位基因模型”,并将多基因负荷(polygenic burden)与单基因血液疾病建立联系。

作者们利用英国生物库(UK Biobank)对欧洲血统的408112名参与者的进行全基因组发现分析,重点在于研究29种血细胞表型。同时,对血细胞协会(Blood Cell Consortium,BCX)的另外154973名欧洲血统参与者中的15种表型的子集进行了遗传关联测试,共鉴定5106个与29种血细胞表型独立相关的,且涵盖影响造血作用的新遗传变异。作为迄今为止最大规模的血细胞性状变异研究,这项研究提供了对血细胞参数调节,以及遗传变异如何影响在稀有血液病中观察到的变异性的新见解。同时,评估了“全方位基因模型”与血细胞表型的相关性,肯定了多基因变异对于复杂性状和疾病风险的重大贡献。此外,该研究为个体遗传背景及该背景可能如何影响血液疾病的表现提供了一个新颖的框架。
然而,由GWAS识别的大多数基因座虽已在欧洲血统(EUR)的人群中被鉴定,但是基于“血液学特征的分布和遗传性血液病的患病率因种族而异”的特性,我们需要更多非EUR的大数据来进一步完全人类的遗传变异谱。
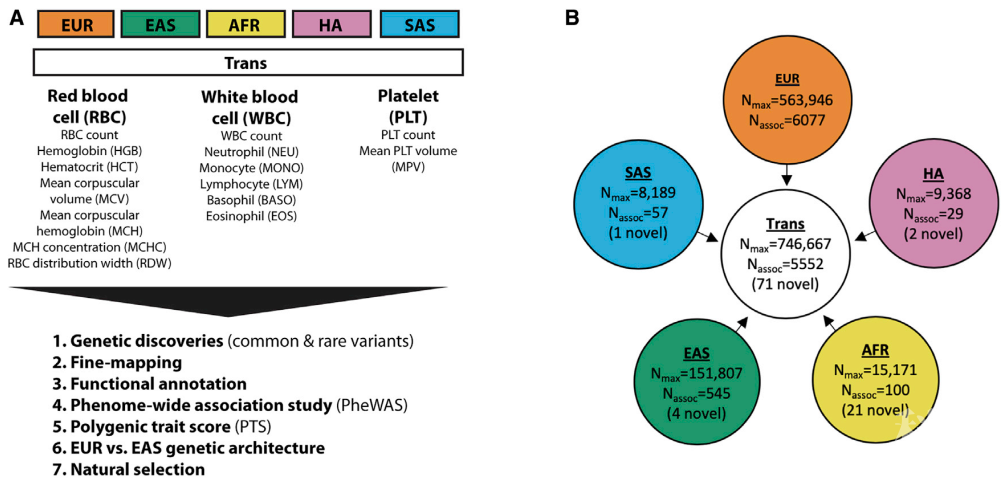
另一篇为来自加拿大蒙特利尔心脏病研究所的Guillaume Lettre课题组与来自美国的威斯康星大学密尔沃基分校的Paul L. Auer 课题组合作发表的题为“Trans-ethnic and Ancestry-Specific Blood-Cell Genetics in 746,667 Individuals from 5 Global Populations”的文章,该研究靶向于多种族队列,分析其血液学特征的遗传结构,以鉴定对非EUR人群具有显著效应的稀有变体,并使用跨种族方法改进GWAS变体的精细映射(Fine-mapping)。

作者针对746667名参与者(包含76%欧洲血统,20%东亚血统,2%非洲血统,1%西班牙/拉美血统,1%南亚)的15种血液学特征,完成多达4500万个常染色体变异的基因型-表型关联的Meta分析,并鉴定了5552个特征-变异关联,其中包含在EUR人群中未发现的71个新基因座。同时,研究人员在血统特异性的非EUR Meta分析中鉴定了额外28个新型变体,包括与体内淋巴细胞计数和体外IL-7分泌水平相关的南亚血统相关的IL7错义变体。这些结果提示跨族群大规模遗传分析的临床意义和预测价值。
此外,这项研究对于未来人类遗传学的影响还在于,1)血细胞性状变异的基因座代表了共享关联(即人群中相似的等位基因频率和效应值)和异质关联(即人群中不同的等位基因频率和效应值)的广泛混合。2)由于等位基因频率和连锁不平衡模式(linkage disequilibrium,LD)在人群中存在异质性,因此可以通过对多个种族的研究来辅助关联信号的精细映射。
总之,这两项研究均表明大规模血细胞特征的GWAS可以在人类广泛等位基因谱中查找具有临床意义的变异。随着越来越多的研究试图揭示构成复杂特征关联的因果变体(causal variation),那么尤其是来自不同血统的遗传证据将发挥重要作用。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652498542&idx=2&sn=fa3f5bd3c9d761d341f03878d97f8af8&chksm=84e279dab395f0cc06ec6e725feee8842638597dc9fe0bb4b782a7af007fdddb406083dfa081#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn