来源:生物谷
人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
2019年4月HIV研究亮点进展
文/towersimper
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。过去4月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
EBioMedicine:重磅!史上首次利用经过编程的MDC1细胞逼迫潜伏的HIV现身并杀死它doi:10.1016/j.ebiom.2019.03.077在治愈HIV病毒感染的第一次尝试中,来自美国匹兹堡大学公共卫生研究生院的研究人员报道他们开发出一种一体化的免疫治疗方法,该方法不仅能够将隐藏在免疫系统中的HIV赶出来,而且还能够杀死它。这种方法的关键在于免疫细胞经设计后可识别一种完全不同的病毒。相关研究结果近期发表在EBioMedicine期刊上,论文标题为“Type 1-programmed dendritic cells drive antigen-specific latency reversal and immune elimination of persistent HIV-1”。
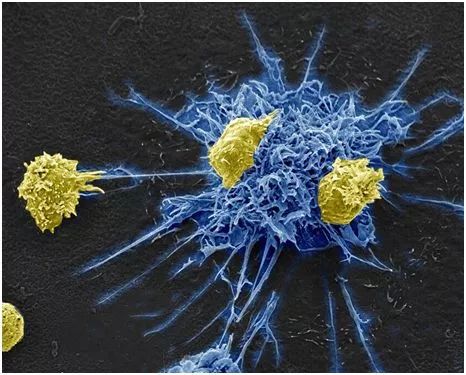
MDC1细胞(蓝色)给携带潜伏性HIV的辅助性T细胞(黄色)传递信号,图片来自Donna Stolz, Ph.D./University of Pittsburgh, Center for Biologic Imaging。
这一发现是在实验室里使用来自HIV感染者的免疫细胞取得的,尚未在临床试验中进行测试,但是它可能会导致人们开发出一种疫苗以便让HIV感染者无需每日服用药物就可控制这种病毒。这些研究人员对“抗原呈递1型极化的单核细胞来源的树突细胞(antigen-presenting type 1-polarized, monocyte-derived dendritic cell, MDC1)”进行改造,这些经过改造的MDC1细胞(monocyte-derived在实验室中经激发后寻找和激活CMV特异性的T细胞,而且他们认为这些特异性的T细胞也可能含有潜伏性的HIV。当将MDC1细胞添加回到含有潜伏性HIV的辅助性T细胞中时,它们会像预期的那样逆转这种潜伏性,从而使得这种病毒无法隐藏。然后大考验来了。Mailliard说,“不用加入任何其他的药物或疗法,MDC1细胞能够招募杀伤性T细胞来清除这些受到HIV感染的细胞。仅通过MDC1细胞,我们就实现先赶出后杀死---这就像是免疫疗法中的瑞士军刀。据我们所知,这是首次研究对树突细胞进行编程,使得它们结合CMV来将潜伏性的HIV赶出,同时也会获得杀伤作用。”
JCI Insight:某些情况下尽管HIV病毒被抑制,免疫系统还是会遭到破坏!doi:10.1172/jci.insight.127113抗逆转录病毒疗法(ART)通常可以非常有效地抑制人体中的艾滋病毒,通过阻止病毒破坏CD4+ T细胞使人体免疫系统得以恢复。但是科学家们现在发现了一种罕见的、矛盾的对ART的反应,这种反应被称为极端免疫衰退(extreme immune decline,EXID)。这项于近日发表在《JCI Insight》上的研究发现,尽管艾滋病毒被抑制到低于检测水平超过三年,但是美国国家过敏症和传染病研究所(NIAID)测试的五名患者还是经历了CD4 + T细胞水平的大幅下降的情况。该研究小组由医学博士Irini Sereti以及Andrea Lisco博士领导,前者是NIAID免疫调节实验室HIV发病机制部门的负责人。研究人员发现,EXID患者的免疫系统比另一组免疫无应答者(INRs)的免疫系统更差,后者对ART的反应不足。INR参与者进行ART治疗后四年,其血液中的CD4 + T细胞水平平均增加了193个细胞/每微升(μL)。对抗逆转录病毒治疗正常反应的参与者CD4+ T细胞数量增加了两倍以上。相比之下,五个经历EXID的参与者血液中的CD4+ T细胞数量平均减少157个细胞/μL,但是他们却始终保持对病毒的抑制。
Science子刊:抗生素复方新诺明可减少HIV感染者的不良健康事件doi:10.1126/scitranslmed.aav0537在一项新的研究中,来自英国、加拿大、乌干达和津巴布韦的研究人员发现一种称为复方磺胺甲恶唑(cotrimoxazole,也称为复方新诺明)的常用抗生素可降低儿童HIV病毒感染者的不良健康事件。相关研究结果发表在2019年4月3日的Science Translational Medicine期刊上,论文标题为“Cotrimoxazole reduces systemic inflammation in HIV infection by altering the gut microbiome and immune activation”。在这篇论文中,他们描述了在年轻的HIV患者中测试这种抗生素的有效性以及他们获得的发现。这些研究人员给生活在乌干达和津巴布韦的293名儿童HIV感染者提供了复方磺胺甲恶唑,为时96周。他们随后收集了所有儿童HIV感染者的血浆样本,随后停止对其中的一半儿童给送这种抗生素。他们在48周后再次收集了所有儿童的血浆样本,并对他们发现的结果进行了比较。这些研究人员报道相比于停止服用复方磺胺甲恶唑的儿童,继续接受这种药物治疗的儿童具有更低的全身性炎症。他们还发现肠道中的链球菌活性水平下降了。更具体地说,他们发现停止服用这种抗生素的儿童出现不良健康事件的可能性比继续使用该药的儿童高出18%。在进一步研究这种抗生素对身体的影响时,这些研究人员发现在16名成年HIV感染者中,它对免疫细胞有直接影响,能够抑制炎症分子产生。他们得出的结论是,尽管对这种抗生素产生广泛的抗药性,但是给HIV毒感染者提供这种药物能够在一定程度上缓解这些感染者身上出现的健康不良事件。
JEM:利用CRISPR/Cas9对B细胞进行基因编辑有望开发出HIV疫苗doi:10.1084/jem.20190287人体不能自然地保护自己免受HIV病毒感染---至少通常不能做到这一点。但是,在极少数情况下,受感染的个体会产生对抗这种病毒的广泛中和抗体(bNAb)。如今,在一项新的研究中,来自美国洛克菲勒大学的研究人员设计出一种方法,将这种对抗HIV的能力赋予给普 通的免疫细胞。相关研究结果于2019年4月11日在线发表在Journal of Experimental Medicine期刊上,论文标题为“HIV-specific humoral immune responses by CRISPR/Cas9-edited B cells”。论文通讯作者为洛克菲勒大学的Michel C. Nussenzweig博士。
图片来自Journal of Experimental Medicine (2019). DOI: 10.1084/jem.20190287。
Nussenzweig和他的同事们使用CRISPR-Cas9基因编辑技术来修饰B细胞,即一种分泌抗体的白细胞。具体而言,他们对小鼠B细胞进行基因改造,使得它们自己产生人bNAb。他们发现,以这种方式发生改变的B细胞产生的抗体水平足以保护小鼠免受HIV感染,这表明这种技 术最终可能用作一种免疫工具。虽然这项研究仍处于早期阶段,但是它证实了通过基因编辑增强免疫应答的可行性。重要的是,这种技术不会影响生殖细胞,因而避免了有时由CRISPR干预引起的伦理问题。如果能够实现,这种新的免疫方法不仅可以用于治疗HIV感染,而且还可以用于治疗任何对特定抗 体敏感的疾病。
New Engl J Med:重大进展!新抗体可以抑制HIV长达4个月!且不会产生耐药性!doi:10.1056/NEJMoa1802264根据一份近日在线发表在《New England Journal of Medicine》上的最新研究,对于正在经历短期暂停抗逆转录病毒疗法(ART)方案的病人而言,定期注入一种可以阻断艾滋病毒在人类免疫细胞的结合位点的抗体可以在长达四个月的时间里抑制艾滋病毒水平的。2期开放性研究结果表明,这种名为UB-421的抗体是安全的,不会诱导产生具有抗体耐药性的艾滋病毒。这项研究由美国国立卫生研究院下属的国家过敏与传染病研究所(National Institute of Allergy and Infectious Diseases,NIAID)和United Biopharma, Inc公司提供部分支持。这项研究在台湾进行,由United Biopharma, Inc公司首席科学官兼董事长Chang Yi Wang博士领导。29名HIV病毒控制良好的志愿者在第一次注射或一周后停止了他们的日常口服抗逆转录病毒药物治疗方案。14名研究参与者每周定期注射8次UB-421, 15名参与者每隔一周注射8次高剂量UB-421。在8或16周的治疗期结束时,所有志愿者重新开始他们之前的ART方案,并在8周后的随访中进行评估。除了一名由于轻微皮疹而停止研究的参与者外,两组志愿者在没有抗逆转录病毒治疗的整个治疗期间都保持了艾滋病毒抑制的良好状态(血浆艾滋病毒RNA水平低于20拷贝/毫升)。
Nature:发现HIV病毒躲避免疫系统杀伤的新方式doi:10.1038/s41586-019-1101-y一个耶鲁大学领导的研究团队已经发现了HIV用于应对免疫系统攻击而生存下来的另一个分子,这项发现将影响科学家们开发有效对抗HIV/AIDS疫苗的思路。HIV病毒会在其表面形成一种被称为三聚体的具有特殊形状的结构,病毒会利用这些结构去粘附、感染细胞并产生更多的HIV病毒。为了避开免疫系统的攻击,这些三聚体可以随着时间改变形状,因此具有三种不同的构象。科学家们现在正在开发的疫苗就旨在靶向其中一种构象,从而引发机体对抗病毒的免疫反应。但是这项最新发表在《Nature》上的研究表明HIV也许可以通过藏在另一个三聚体构象(被称为State 1)中躲避免疫系统的检测。据研究人员报道,病人会通过产生广泛的中和抗体来对抗HIV,其中大多数抗体识别的是处于State 1构象的病毒。“如果这些抗体可以结合处于State 1构象的三聚体,那么疫苗中的任何免疫原都可以识别这个构象。”该研究共同通讯作者、微生物病理学教授Walther Mothes说道。“但是令人惊讶的是,现有的免疫原只识别State 2构象,会产生State 2构象特异性的抗体。”
Cell Host & Micro:揭示HIV未知弱点 有望开发出消灭HIV的新型策略doi:10.1016/j.chom.2019.03.002试想一下,HIV是一个密封的锡罐,如果我们打开它的话能够找到什么呢?近日,一项刊登在国际杂志Cell Host & Microbe上的研究报告中,来自蒙特利尔大学等机构的科学家们通过研究首次直观地观察到了打开HIV的样子,揭示了此前未知的病毒形状,同时也阐明了HIV弱点的详细图像信息,本文研究中研究人员有望暴露出HIV的弱点,从而利用特殊抗体就能靶向杀灭HIV。
图片来源:thetraveldoctor.com.au。
研究者Andres Finzi教授说道,病毒包膜新形状的特点揭示了HIV易感性的详细信息,未来研究人员有望开发新型策略来靶向作用HIV的弱点从而抑制HIV的感染和传播。当HIV感染机体免疫系统细胞时,其会利用包膜刺突来将病毒颗粒吸附到CD4和CCR5细胞的特殊受体上,与CD4细胞的结合能诱发病毒包膜形状改变从而促进病毒感染细胞,研究人员表示,利用一种小分子CD4模拟化合物就能促进病毒打开自身结构将易感部位暴露出来,这样机体免疫细胞就能有效杀灭被病毒感染的细胞了。研究者表示,暴露病毒包膜的易感部位或能促进一种抗体依赖性的细胞毒性作用(ADCC)机制来清除被HIV感染的细胞。文章中,研究者利用了一种名为单分子共振能量转移技术(smFRET)观察了此前未知的病毒包膜形状,该技术还能帮助研究者观察病毒包膜的不同元件如何相对于彼此运动,这或许就能提供一种直接的方法来帮助研究者进行观察,HIV包膜是一个携带多种部件的动态机器,这就使其能采取多种形状对诸如抗体或小分子产生反应。研究者James Munro说道,我们希望观察病毒包膜的形状能够帮助开发利用ADCC的候选疫苗,在smFRET技术的帮助下,研究者们就能更好地理解HIV-1如何感染人类细胞,在泰国进行的一项临床试验中(也是唯一的疫苗试验),研究者发现了机体抵御HIV感染的适度保护特性,即携带ADCC活性的抗体或是诱发保护能力的一个关键因素。
PLoS Pathog:警惕!性行为或会影响机体微生物组并增加HIV感染风险doi:10.1371/journal.ppat.1007611近日,一项刊登在国际杂志PLoS Pathogens上的研究报告中,来自科罗拉多大学的科学家们通过研究发现,个体的性行为或会影响其机体微生物组和免疫系统的健康,从而增加其HIV感染的风险。微生物组是机体肠道中的微生物群落,其在驱动和塑造人类机体免疫系统上扮演着关键角色,但最近有研究表明,相比与异性性接触的男性而言,与男性有性接触(MSM男男性行为)的男性机体中有着非常不同的微生物组(无论其HIV感染状况),因此研究者就想知道是否性行为对象性别的差异所引发的机体微生物组的改变会诱导T细胞激活相关的HIV传播风险和疾病严重程度的增加。这项研究中,研究人员收集了35名健康男性的粪便样本,并将粪便样本移植到小鼠机体中,这些男性包括进行男男性行为和与异性有性行为的个体,研究者发现,接受MSM个体粪便样本移植的小鼠机体中CD4+ T细胞的激活水平会增加,这就会增加其HIV感染的风险(如果是人类的话)。随后研究者从HIV阴性个体的肠道中分离出免疫细胞,并将这些细胞暴露于来自MSM个体和其粪便样本中的细菌,结果发现,暴露于MSM个体粪便细菌中的人类肠道免疫细胞在体外更容易被HIV感染,这或许与粪便中细菌所引发的免疫活性激活有关。研究者Brent Palmer教授表示,本文研究结果阐明了HIV阴性和阳性MSM个体机体中微生物组与免疫激活之间的直接关联,同时也为阐明肠道微生物组作为HIV传播的风险因素建立了一定的理论基础。
PLoS ONE:定时阴道授精有望让受到HIV感染的夫妇安全怀孕doi:10.1371/journal.pone.0212656因担心HIV病毒可能传染给后代,感染这种病毒的女性曾被建议不要生孩子。但是医学进步不仅让HIV感染者能够过上更长寿更充实的生活,而且还能让他们的家庭得以成长。在一项新的在肯尼亚开展的前导性研究中,来自美国、肯尼亚和瑞士的研究人员发现定时阴道授精(timed vaginal insemination)是一种安全有效的方法来帮助受到HIV感染的夫妇安全怀孕。相关研究结果近期发表在PLoS ONE期刊上,论文标题为“Empowering HIV-infected women in low-resource settings: A pilot study evaluating a patient-centered HIV prevention strategy for reproduction in Kisumu, Kenya”。

在23对夫妇(女方是HIV阳性,而男方是HIV阴性)中,定时阴道授精导致6名没有感染上HIV的活产婴儿出生。美国密歇根大学医学院妇产科助理教授Okeoma Mmeje博士说,“遭受HIV稳定感染的人们专注于完全融入社区和过上富有成效的生活。HIV确实不会改变一个人生孩子的愿望。我们的研究描述了一种安全有效的可行方法来帮助受到HIV感染的女性实现怀孕。”
PNAS:驱动HIV存储库细胞自我毁灭有望开发出新型HIV疗法doi:10.1073/pnas.1818662116尽管当前的HIV疗法能够成功控制病毒的活动性感染,但HIV能在组织储存库(包括巨噬细胞)中长久存活,而这很显然是一个持久性的问题;近日一项刊登在国际杂志PNAS上的研究报告中,来自康乃尔大学的科学家们通过研究找到了一个攻击HIV的新方向,其或能在不影响机体健康细胞的情况下,有选择性地清除HIV病毒储存库细胞。文章中,研究者描述了名为SAF的遗传调节子如何帮助HIV感染的巨噬细胞免于细胞死亡的,当阻断感染HIV的细胞中SAF的功能时,研究者发现,这些病毒储存库细胞会自我破坏,研究者对这些细胞死亡的特异性感到非常惊讶,只有受感染的细胞会发生死亡,而处于相同剂量及相同疗法的旁观者细胞则不会完全死亡。这项研究中,研究人员想通过研究调查哪些细胞机制能够帮助维持受感染的巨噬细胞存活,随后他们将注意力转移到了对长链非编码RNAs (lncRNAs)进行研究,这类遗传编码元件能帮助开启或关闭基因表达,但并不会直接翻译为蛋白质;研究者非常感兴趣研究lncRNAs,因为其是细胞通路的主要调节子,而且并未对HIV感染进行系统性地研究。研究人员对三类不同的人类巨噬细胞中90个具有特性的lncRNAs进行筛选研究,这三类巨噬细胞包括健康细胞、HIV感染细胞、旁观者细胞(bystander cells),旁观者细胞是暴露于HIV但并未受到感染的细胞。研究者发现,在HIV感染的巨噬细胞中,名为SAF的lncRNA明显被上调了,而且此前研究结果表明,SAF能抑制细胞凋亡;因此研究者推测,SAF或能保护HIV感染的巨噬细胞免于死亡。为了证实这一猜测,研究者利用siRNA(小型感染RNA)阻断了SAF的功能,siRNA能选择性地降解RNAs(比如SAF),随后研究者在上述三类细胞中沉默了SAF的表达,结果发现,HIV感染的细胞会突然发生自我毁灭,而健康细胞和旁观者细胞则并不会受到影响。
来源:BIOONNEWS 生物谷
原文链接:http://mp.weixin.qq.com/s?__biz=MzI2NjY1NjA5Mw==&mid=2247501699&idx=1&sn=d9a5fa4db77ebad2f0dd4bd914a16860&chksm=ea8847b1ddffcea73bff14171079b8455bffa303eee4b20bd6938d0e531c63b14c0a52682f64&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn