来源:BioArt
原标题:只为更清楚的认识癌症!Cell丨章冰团队等运用全蛋白组数据为癌症治疗提供更精准的方案
作为全世界第三常见的癌症,肠癌(colon cancer)死亡率在所有癌症中排第四位。近些年来,随着各种测序技术的发展,科学家们绘制了肠癌的各种基因组图谱、转录组图谱和蛋白质组图谱。通过这些图谱,科学家们鉴定出了许多与肠癌相关的基因突变和蛋白改变【1】。然而,这些爆发式增长的组学数据一方面并没有为临床诊断带来新的标志物或者治疗靶点,另一方面这些数据缺乏对大队列人群系统性地的分析。
不仅是肠癌,在多癌种方面,癌症基因组图谱计划 (TCGA) 通过大规模的癌症样本取样和全基因组、转录组测序,虽然全面地总结了各种癌症的基因组异常(例如体细胞突变,基因拷贝改变,基因甲基化异常,基因表达等等),并且提供了初步的癌细胞增殖和存活的生物解释,但是TCGA大数据能够直接转化成临床治疗或者给临床治疗改进提供新思路的例子还是很少。
2019年4月25日,由美国贝勒医学院章冰团队和癌症研究院(National Cancer Institute,NCI)领导的一项关于肠癌蛋白组-基因组(Proteomgenomics)研究在 Cell 杂志发表,标题为Proteogenomic Analysis of Human Colon Cancer Reveals New Therapeutic Opportunities 。该研究在TCGA的基础上鉴定了全蛋白组(包括蛋白的修饰),从而获取了对癌细胞更清晰的认知,以及给予临床治疗更直接的改进方案。

在本项研究中,研究人员收集了110例肠癌样本,并且用现代组学技术定量蛋白表达和蛋白磷酸化数据。他们在这个基础上用高质量的生物信息学分析探讨以下几个问题:1. 癌细胞异常的基因组改变如何影响蛋白水平的生物信号;2.癌细胞表达哪些蛋白可以作为临床检测的标记或者治疗的靶点;3. 整合蛋白组-基因组的分析能否提供癌症个体化精准治疗方案(personalized/precision medicine)。
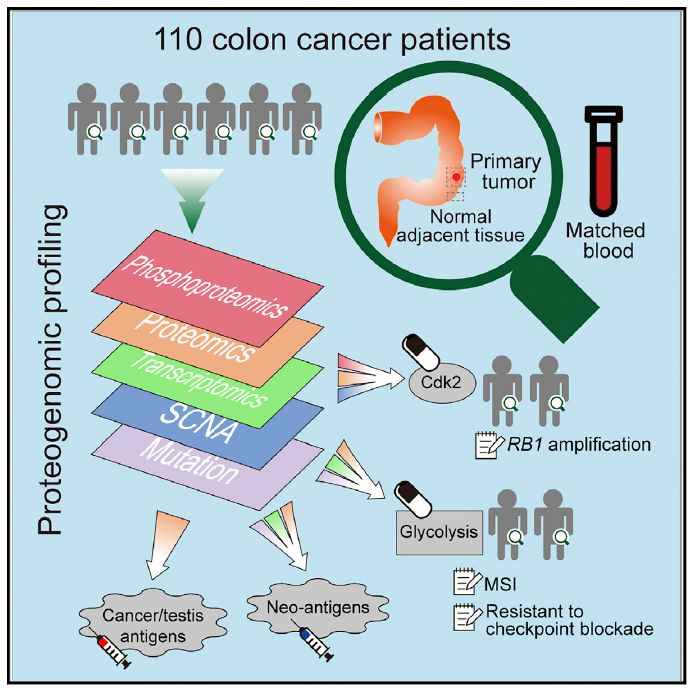
在该研究中:
1. 研究人员首先证明了蛋白质组学无可替代的重要作用,对于某些之前仅有基因水平观测得到的结论,他们发现蛋白组学能够提供必要的矫正。例如SOX9基因有很多的截短突变(truncation mutation),若按照基因水平的评估,截短突变的基因属于抑癌基因。然后蛋白质组学定量发现即使有SOX9截短突变的样本里,该基因的表达量仍然被上调了。进一步发现SOX基因突变增加了蛋白的稳定性,因此蛋白水平证实了SOX9是个原癌基因。
2. 在肠癌中,人们一直不解为何抑癌基因RB1没有突变或者缺失,而且它的拷贝数在一些病人里反而增加了。在这项研究中,他们发现,癌细胞抑制RB1的功能是通过蛋白磷酸化实现的。更重要的是,磷酸化的RB1不仅能够抑制其功能,而且会促进癌细胞存活。这个结论不仅解释磷酸化RB1的对癌细胞的多种影响,而且也提供了一个思路,即针对RB1激酶的药物或许能有效治疗RB1拷贝数增加的肠癌病人.
3. 有一部分肠癌病人基因组是高度突变的(hypermutated),因此被认为适用于接受癌症免疫治疗(因为突变蛋白能够激发免疫反应)。然而,免疫治疗只能对一部分的此类病人起作用。在这项研究中,他们发现,在蛋白水平上表征的糖酵解(Glycolysis)很可能抑制T细胞的抑癌作用。所以,针对这类病人,他们提出了免疫治疗配合抑制癌细胞糖酵解的治疗思路。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652469474&idx=1&sn=923aace69536d810f6ab5cf5c52301bd&chksm=84e2eb56b395624087e08c235133b09770e35ae558f1b599a017a1cdee22e93dafbca51da37d&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

