来源:X一MOL资讯
G蛋白偶联受体蛋白(GPCRs)又称七次跨膜螺旋膜蛋白。GPCRs参与着人体的各种生理功能,包括神经信号传递、细胞分化、视觉、嗅觉等。人类的重大疾病如老年痴呆症、癌症、艾滋病也与GPCRs密切相关。GPCRs是最为热门的药物设计和筛选靶标蛋白,目前40%左右的上市药物都是基于GPCRs而设计。因此研究和理解GPCRs的结构与功能,对当今药物设计至关重要。
每个蛋白质的特有生理功能与活性,是由它特定的三维结构决定的。因此从蛋白三维结构来理解GPCRs的功能是当今药物设计中必不可少的一个环节。随着结构生物学技术突飞猛进的发展,截止到2019年4月底,已经了62个不同种类的GPCRs结构被解析出来。这其中涵盖了GPCRs 的A、B、C和F亚家族。然而,嗅觉受体蛋白占据着人源GPCR家族的30%以上,但其结构和功能至今还未很好地被人们所熟知。至今为止,还没有任何的嗅觉受体蛋白的结构被人们解析出来。人工智能和计算生物学在此情况下为人们理解嗅觉受体蛋白结构及其药物分子的功能提供了有力的工具。
在本文介绍的工作中,作者首先通过计算机模拟的方法构建出嗅觉受体蛋白Olf73的三维结构模型(同源性与晶体结构只有18%)。然后通过分子动力学的方法优化初始模型的三维构象。在通过人工智能和计算机虚拟高通量筛选药物分子的方法预测158万个化合物库中有25个新型分子可能是有活性的。最后生化实验证实,所预测的化合物中17个确实是有活性,命中率高达68%(图1)。
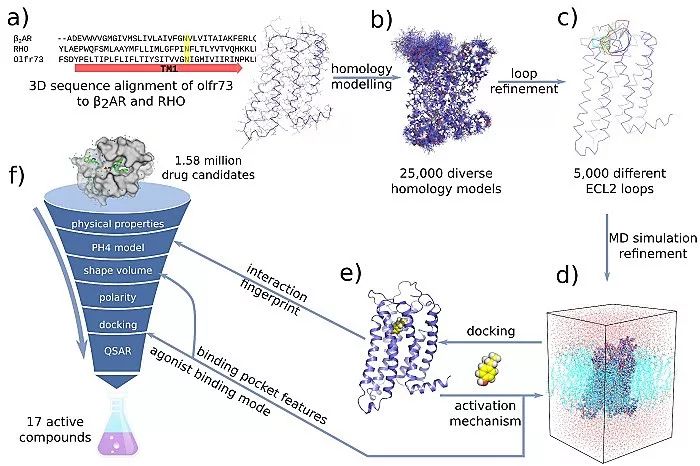
图1. 人工智能和计算机虚拟高通量筛选药物分子
除此之外,作者还发现嗅觉受体蛋白的药物分子的分子量比其他GPCR家族要小很多,并且活性要小不少。通过人工智能分析药物分子与靶标蛋白的相互作用指纹图谱发现,嗅觉受体蛋白的药物分子主要以疏水作用为主,而其他GPCR的活性分子则以氢键和盐桥作用为主。功过系统分析GPCR的药物分子结合位点的大小,作者进一步发现嗅觉受体蛋白的位点比其他GPCR明显要小很多。结合位点区域的电荷也比其他GPCR要少很多(图2)。这些因素综合导致了嗅觉受体蛋白的活性分子整体活性比其他GPCR要小不少。
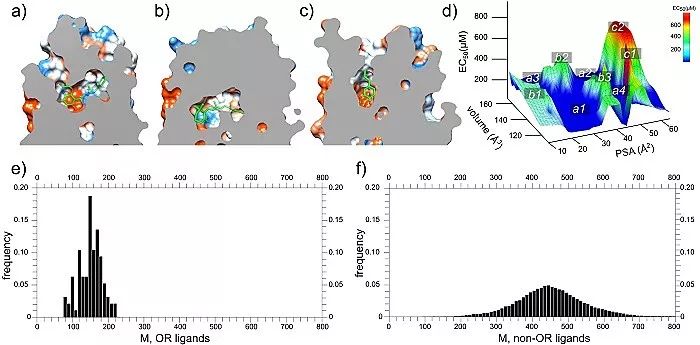
图2. 嗅觉受体蛋白与其他GPCR的性质比对
本工作为基于嗅觉受体蛋白的药物发现与设计提供了有力的理论基础和依据。相关论文于2019年4月24日在线发表于Nature 子刊Communications Biology 上。第一作者为袁曙光,通讯作者为袁曙光和Horst Vogel。第一单位为中国科学院深圳先进技术研究院。
Computational modeling of the olfactory receptor Olfr73 suggests a molecular basis for low potency of olfactory receptor-activating compounds
Shuguang Yuan, Thamani Dahoun, Marc Brugarolas, Horst Pick, Slawomir Filipek, Horst Vogel
Commun. Biol., 2019, DOI: 10.1038/s42003-019-0384-8
作者简介
袁曙光,2009年获得中科院上海有机化学研究所硕士学位。2009年10月获得欧盟玛丽居里全额奖学金资助,先后在比利时鲁汶大学(KULeuven)、波兰科学院、洛桑瑞士联邦理工学院(EPFL)完成博士学位。2013年6月获得最佳博士论文奖。近年来,袁曙光博士一直致力于GPCRs计算机模拟研究。通过全原子长时间尺度的分子动力学模拟(all-atom long time scale molecular dynamics simulation),揭示GPCRs的激活机制和小分子的特异性原理。2013年,作者首次发现了钠离子在鸦片受体(mu opioid receptor)的激活过程中的机理 (Angew. Chem. Int. Ed., 2013, DOI: 10.1002/anie.201302244)。2014年,作者通过对Rhodopsin、A2AR和β2AR三个GPCRs受体的系统研究, 首次发现了GPCRs被激活的时候,在GPCRs内部能够形成连续的水分子通路(Nature Communications, 2014, DOI: 10.1038/ncomms5733)。同年作者又揭示了GPCRs 形成水分子通路的开关(Angew. Chem. Int. Ed, 2013, DOI: 10.1002/anie.201409679)。2015年,作者发现了鸦片受体的小分子特异性原理,系统阐述了为什么两个结构上非常相似的小分子其中一个是激动剂,而另外一个则是拮抗剂(Angew. Chem. Int. Ed, 2015, DOI: 10.1002/anie.201501742)。该工作并被主编选定为热门文章。2016年,作者揭示了5-HT1A受体的立体选择性原理 (Angew. Chem. Int. Ed., 2016, DOI:10.1002/anie.201603766)。同年,作者还发现了P2Y1受体两种不同的拮抗剂抑制机制(Angew. Chem. Int. Ed., 2016, DOI: 10.1002/anie.201605147) 。2018年,作者通过分子动力学的方法,发现了GPCR药物分子的新的结合位点 (Chemical Science, 2018, DOI: 10.1039/C8SC01680A)。2018年,袁博士被波兰华沙大学授予"特任教授"称号。2019年,袁博士被中国科学院深圳先进技术研究院聘为正研究员。同时他也是先进院“计算机辅助药物设计研究中心”的主任。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657610416&idx=5&sn=4a84b823d6e7db64f6475f98b86c0185&chksm=80f7c360b7804a764356ac2e058a795ba340bd57e8cb65037f08f3c4a6a1bfbe8c7283e67bfc&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



