来源:BioArt
撰文:敏君
宿主与微生物群落之间存在着复杂的相互作用,影响着机体生命活动的方方面面。然而这种相互作用是如何影响宿主组织结构和生理机能的退行性改变,即衰老过程,目前仍知之甚少。秀丽隐杆线虫(C. elegans)在生命周期中表现出诸如生殖和肌肉骨骼退化等与人类衰老类似的变化,是研究衰老的模式物种【1】。继首次在啮齿动物中发现饮食限制能够延长寿命后,研究人员在包括线虫在内多种生物体中发现了相似的现象,并发现TOR能量传感途径【2】,胰岛素/胰岛素样生长因子1信号(IIS)途径和线粒体调控信号在其中发挥重要功能【3,4】。
2019年4月8日,华盛顿大学医学院Kerry Kornfeld教授团队在Developmental Cell杂志发表最新研究成果:Lifespan extension in C. elegans caused by bacterial colonization of the intestine and subsequent activation of an innate immune response。本研究在线虫中发现了一种意想不到的寿命延长机制:细菌定植会激活线虫先天免疫反应和细菌逃避行为,从而诱导饮食限制,最终导致线虫压力应激反应增强及寿命的延长。

本文首先通过正向遗传筛选发现am117能够延迟体细胞衰老,表现出极瘦的身体形态,诱导逃避菌苔的行为,并能增强压力应激水平。为研究am117的调控机制,作者利用am117与其它寿命调节通路关键调控基因(如daf-2/16、isp-1、aak-2、rict-1、eat-2)构建了线虫双突变体模型,确定am117与参与饮食限制调控的eat-2有较强的遗传学相互作用【5】。定位克隆实验证明am117突变所影响的基因为phm-2。PHM-2是人类蛋白支架附着因子B(SAFB)的同源蛋白,包含两个高度保守蛋白结构域,即SAP结构域和RRM_SAF结构域。phm-2基因在线虫中表达非常广泛,但其编码的蛋白特异性定位于细胞核内。phm-2突变体咽部研磨功能缺陷,导致活细菌进入肠腔【6】,因此对致病菌高度敏感,添食高致病性细菌,会缩短缺陷型线虫寿命。而添食标准大肠杆菌,活体大肠杆菌进入phm-2突变体肠腔,导致微弱毒力和细菌逃避行为,并表现出典型的细菌感染后的转录水平与分子水平上的改变,突变体寿命延长。这些结果揭示,phm-2基因通过细菌定植引发虫体逃避食用细菌食物等先天免疫反应,影响了线虫的寿命。
eat-2(If)突变会导致进食缺陷,咽磨床功能异常,降低线虫能量与营养摄取,并延迟衰老,目前eat-2突变体已成为饮食限制与寿命调控的研究模型。而在本研究中作者出人意料的发现,与phm-2突变体类似,活体大肠杆菌会在eat-2(If)突变体肠内积累,导致先天免疫激活和细菌逃避行为。进一步研究表明,用非致病性细菌培养eat-2(If)突变体会导致细菌逃避、体型变瘦和寿命延长表型受到抑制。因此,eat-2和phm-2突变体导致的寿命延长并不是单单由饮食限制导致的,而是细菌定植、先天免疫激活、细菌逃避和饮食限制等多种因素相互影响导致的结果。
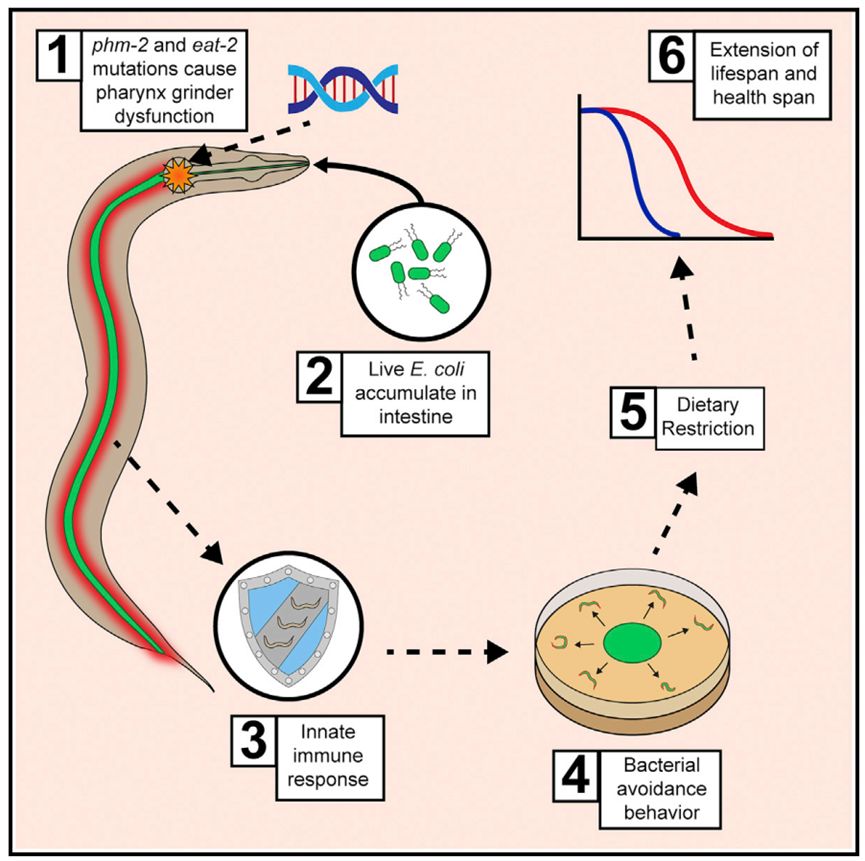
本研究通过精密巧妙的论证,提出了一种崭新的线虫寿命调控机制,让我们认识到线虫寿命调控远比我们想象的要复杂。
原文链接:
https://doi.org/10.1016/j.devcel.2019.03.010
制版人:珂
参考文献
1. Brenner, S. (1974). The genetics of Caenorhabditis elegans. Genetics 77, 71–94.
2. Kapahi, P., Chen, D., Rogers, A.N., Katewa, S.D., Li, P.W.L., Thomas, E.L., and Kockel, L. (2010). With TOR, less is more: a key role for the conserved nutrientsensing TOR pathway in aging. Cell Metab. 11, 453–465.
3. Kenyon, C.J. (2010). The genetics of ageing. Nature 464, 504–512.
4. Hansen, M., Hsu, A.L., Dillin, A., and Kenyon, C. (2005). New genes tied to endocrine, metabolic, and dietary regulation of lifespan from a Caenorhabditis elegans genomic RNAi screen. PLoS Genet. 1, 0119–0128.
5. Lakowski, B., and Hekimi, S. (1998). The genetics of caloric restriction in Caenorhabditis elegans. Proc. Natl. Acad. Sci. USA 95, 13091–13096.
6. Portal-Celhay, C., Bradley, E.R., and Blaser, M.J. (2012). Control of intestinal bacterial proliferation in regulation of lifespan in Caenorhabditis elegans. BMC Microbiol. 12, 49.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468512&idx=3&sn=d820dd009f6d6b7ca8c3f6cdd995ab4b&chksm=84e2e694b3956f8220f5838b59d3a6c436441cac7d4aa301893967f67d13eff994ae0b557465&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


