来源:BioArt
撰文| 马洪第
近些年来,临床和实验的大量研究证据表明肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)在肿瘤的生长,侵袭以及转移等过程中均发挥非常重要的作用【1】。巨噬细胞是一类可塑性非常强的免疫细胞,它们所处的解剖位置以及生理或者病理环境决定了它们的表型特征。经典活化巨噬细胞(classically,也称为M1)和选择性活化巨噬细胞(alternatively,M2)代表了两种完全不同类型的巨噬细胞【2】。其中,肿瘤相关巨噬细胞TAMs,主要表现出M2巨噬细胞的表型特征:可以由IL-4诱导,产生大量的免疫抑制性细胞因子IL-10而不是IL-12,表达清道夫受体,主要发挥抵抗炎症和组织修复的功能【3】。因此,大部分研究表明TAMs的大量浸润与肿瘤发展和不良预后紧密相关,但是在某些情况下,一些特别的TAMs亚群,表现出M1巨噬细胞的表型特征:被微生物产物如LPS或者细胞因子IFN-γ活化,分泌大量的促炎性细胞因子和趋化因子,招募更多的T细胞等杀伤细胞参与肿瘤杀伤,能够极大地改善肿瘤病人的预后及生存【4】。
M1巨噬细胞不仅具有肿瘤杀伤的活性,而且还能够活化杀伤性淋巴细胞例如T细胞,NK细胞等促进抗肿瘤免疫;而在肿瘤微环境中,巨噬细胞很快转化成M2巨噬细胞的表型,通过免疫抑制调控和提供营养功能促进肿瘤的生长。目前,在肿瘤微环境中TAMs进行重编程,转换表型的具体机制尚不清楚。
法国国立马赛吕米尼免疫中心(CIML)的Toby Lawrence领导的研究团队于2019年3月28日在Cell Metabolism上在线发表题为Membrane Cholesterol EffluxDrives Tumor-Associated Macrophage Reprogramming and Tumor Progression的研究论文,对TAMs在肿瘤微环境中的重编程机制进行了深入研究,提出肿瘤细胞促进TAMs膜胆固醇外排驱动了TAMs的重编程,使其促进肿瘤生长。研究者证明了在卵巢癌模型中,以巨噬细胞中的胆固醇外排为靶点进行阻断,可以对抗这种重编程,减缓肿瘤的进展,提供了一种新的肿瘤治疗策略。

在该研究中,研究者利用转移性卵巢癌模型对TAMs展开研究。即将小鼠卵巢上皮癌细胞ID8以腹腔注射的方式转输到小鼠体内,这些细胞逐渐使受体小鼠发展成恶性腹水,肿瘤结节遍布整个腹腔,该模型能够很好地模拟人的高级别浆液性卵巢癌的特征。
研究者首先在该肿瘤模型中对TAMs进行了亚群分析及表型检测,发现外周血单核细胞来源(MN-derived)的TAMs逐渐替代了胚胎前体细胞来源的驻留巨噬细胞。并且转录组学分析表明,随着肿瘤的进展,TAMs胆固醇代谢以及外排相关基因的表达显著上调。
进一步的实验发现卵巢癌细胞通过分泌一种胞外基质组分-透明质酸(hyaluronic acid, HA)能够促进巨噬细胞膜胆固醇外排(membrane-cholesterol efflux),进而导致细胞膜上富含胆固醇的脂筏(lipidraft)缺失。这一过程会促进巨噬细胞内部IL-4介导的重编程的发生,促使巨噬细胞向IL-4诱导的表型转化,同时破坏了巨噬细胞中IFN-γ相关信号的传递,使得IFN-γ诱导的相关基因表达受到抑制。根据之前的报道我们知道,IL-4诱导的TAMs中的基因表达与其促进肿瘤生长的功能相关,包括增加精氨酸代谢促进免疫抑制以及提供营养支持肿瘤细胞的侵袭和转移【5】;而IFN-γ诱导TAMs表达的基因是参与其抗肿瘤功能的。这表明胆固醇外排导致TAMs抗肿瘤能力减弱,更倾向于促进肿瘤的进展。研究者也通过体内实验证明了胆固醇外排通路以及IL-4信号通路在促进肿瘤进展中发挥重要的作用。
进一步的功能实验证明,如果将介导胆固醇外排的ABC转运体(ATP-binding cassette transporters, ABC)基因敲除,则能够阻止重编程的发生,使得TAMs的肿瘤促进作用减弱,肿瘤生长减缓。因此,研究者们提出阻断TAMs中胆固醇外排能够抑制TAMs的促肿瘤生长功能,并且能够恢复其抗肿瘤免疫的能力,提供了一种新的肿瘤治疗策略。
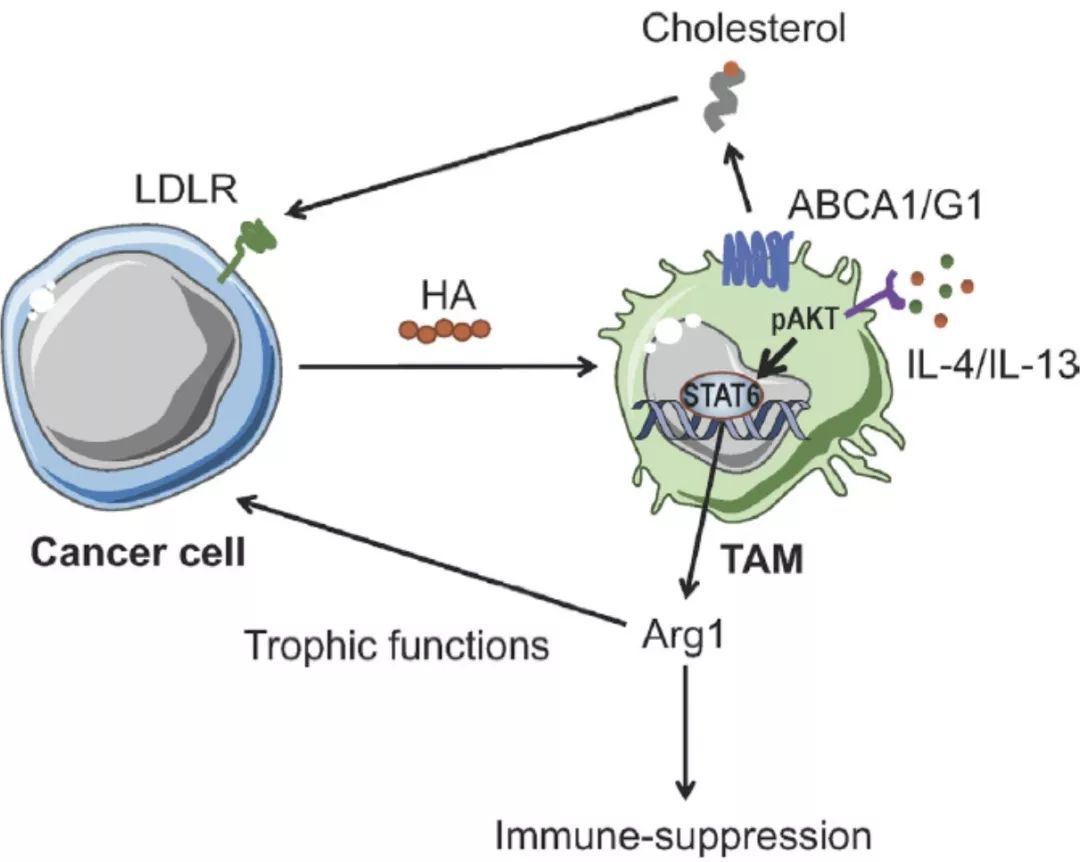
综上所述,研究者提出膜胆固醇外排在肿瘤微环境中能够调控巨噬细胞的活化状态。膜胆固醇的缺失使得巨噬细胞对IL-4等促肿瘤信号反应更加敏感,而抗肿瘤细胞因子IFN-γ对其激活受到阻碍。研究者认为胆固醇外排通路提供了一种新的肿瘤治疗靶点策略,在保留治疗后TAMs潜在的有益的抗肿瘤作用的同时,能够使TAMs的促肿瘤功能丧失。
然而,作者也提出该研究也有一定的局限性,有一些问题尚未阐明。例如,虽然证明了胆固醇外排增加了TAMs对于IL-4的敏感度,促进了肿瘤进展,然而在肿瘤微环境中IL-4的来源目前并不清楚。此外,虽然研究者发现肿瘤细胞通过透明质酸促进了TAMs的胆固醇外排,但是ABC转运体活性在TAMs中显著增强从而促进了胆固醇外排的具体机制并未阐明。这些问题还有待进一步的研究来解答。
原文链接:
https://doi.org/10.1016/j.cmet.2019.02.016
制版人:子阳
参考文献
1. Noy,R. & Pollard, J. W. Tumor-associated macrophages: from mechanisms totherapy. Immunity 41, 49-61, doi:10.1016/j.immuni.2014.06.010 (2014).
2. Gordon,S. Alternative activation of macrophages. Nature reviews. Immunology 3, 23-35,doi:10.1038/nri978 (2003).
3. Mantovani,A. et al. The chemokine system in diverse forms of macrophage activation andpolarization. Trends in immunology 25, 677-686, doi:10.1016/j.it.2004.09.015(2004).
4. deVos van Steenwijk, P. J. et al. Tumor-infiltrating CD14-positive myeloid cellsand CD8-positive T-cells prolong survival in patients with cervical carcinoma.International journal of cancer 133, 2884-2894, doi:10.1002/ijc.28309 (2013).
5. DeNardo,D. G. et al. CD4(+) T cells regulate pulmonary metastasis of mammary carcinomasby enhancing protumor properties of macrophages. Cancer cell 16, 91-102,doi:10.1016/j.ccr.2009.06.018 (2009).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468224&idx=4&sn=b237a660613a6287bb5de1983b069f87&chksm=84e2e7b4b3956ea2f6ff3d921ad2405bf41234ac3be1c946b7179e3b8d72ad060bf82136d306&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

